Etiopatogenia de Granulomatosis de Wegener
La etiología de la GW es desconocida. Han sido infructuosas las investigaciones dirigidas a demostrar un agente infeccioso. Sin embargo, para algunos investigadores el proceso inicial puede estar relacionado con la presencia de un virus, que como el parvovirus B19, podría producir un cambio genómico y como consecuencia uno fenotípico en los neutrófilos y fagocitos mononucleares en el tracto respiratorio superior34. Posteriormente el proceso se prolonga y amplía a otras estructuras.
Los cambios más importantes encontrados en los neutrófilos y fagocitos mononucleares, son la expresión anormal en sus superficies de proteínas potencialmente antigénicas como son la PR3 y la MPO, cuya presencia promovería el desarrollo de los anticuerpos dirigidos contra ellos (c y p ANCAs)35. La expresión de dichos antígenos, cuando el proceso inflamatorio está más avanzado es acelerado por la presencia del Factor de Necrosis Tumoral -a (TNF-a)36.
La fijación de los ANCAs a sus respectivos antígenos en la superficie de los neutrófilos y fagocitos mononucleres, lleva a una alteración en capacidad fagocítica y la activación anormal de los mecanismos de degranulación y de liberación de radicales tóxicos de oxígeno37. Se ha demostrado por ejemplo, una disminución en la actividad anticándida de los polimorfonucleares (PMN) de los pacientes con GW38. Algunos autores consideran que esta alteración se debe al desencadenamiento y posterior “agotamiento” de los mecanismos defensivos descritos37. Los ANCAs promueven en los PMN activados in vitro con TNF-a, la liberación de radicales tóxicos de oxígeno y proteínas de los gránulos, incluyéndose citoquinas como la interleuquina-1b (IL-1b), IL-8, IL-12, TNF-a, Factor de Crecimiento Transformante-b (TGF-b)39-43. El papel de ésta última proteína en la génesis de la enfermedad es de mucha importancia, dado que promueve la traslocación de PR3 a la superficie de los PMN, hecho que se ha calculado experimentalmente, llegándose a conocer que el incremento en el fenómeno es de 51%, basados en modelos in vitro con PMN “iniciados” con dicha citoquina44. El TGF-b también está implicado en el desarrollo de la angiogénesis, capacidad quimiotáctica y en la formación de granulomas45-46. La PR3 activa el TGF-b latente, comparable con el efecto similar que posee la plasmina47.
En la unión de los anticuerpos a antígenos expresados en la superficie (PR3 por ejemplo), también se involucran receptores de la fracción Fc de las inmunoglobulinas (FcgRII), siendo aquí importante la presencia de b2-integrinas. El papel de la formación de estos complejos inmunes en la patogénesis de la GW, es motivo de investigación36.
La PR3 también se ha encontrado expresada en las células endoteliales, quizá a través del estímulo generado por diversas citoquinas, como son el TNF-a, las Interleuquinas -1a y 1b, y el g-interferón, generadas por neutrófilos y fagocitos mononucleares activados48. Los cANCAS in vitro promueven en las células endoteliales, la expresión de moléculas de adhesión como es la VCAM-1 cuyo contrarreceptor es la integrina LFA-1 de los linfocitos B y T, basófilos, eosinófilos y monocitos, promoviéndose así su adhesión49-50. Un efecto similar se ha encontrado con el estímulo para la síntesis y expresión de la E- selectina51. El aumento de la expresión de las moléculas de adhesión a nivel tisular, por ejemplo en el riñón, se correlaciona con el grado de inflamación y daño según se evidencia en modelos experimentales52, y en biopsias de pacientes53. También los ANCAs promueven la síntesis de citoquinas, en particular la IL-1b54.
Más complejo aún es poder encadenar lo anterior anotado con el desarrollo de granulomas. Para algunos autores los cANCAs, que están dirigidos contra la PR3 y que precipitan una degranulación incompleta, conducen hacia un proceso crónico, con el ensamblaje de una reacción inflamatoria que en últimas lleva a una reacción tan compleja como la granulomatosa45-46.
La lesión de los vasos sanguíneos inicialmente se debe a la fijación de los neutrófilos y al efecto de su activación. Posteriormente participan células mononucleares55, situación mediada por la IL-1 liberada de los neutrófilos54. En los tejidos se evidencia un aumento de la expresión de citoquinas proinflamatorias además de ANCAs56. Los blancos son la PR3 y la MPO presentes en la superficie de los PMN57-61.
Otro grupo de anticuerpos diferente a los ANCAs, estudiados en la GW, son los anticuerpos anticélulas endoteliales (AECAs), los cuales inducen la expresión de diversas moléculas de adhesión como son la E-selectina, la ICAM-1, la VCAM-1, así como la liberación de citoquinas como son la IL-1, la IL-6, la IL-8 y la proteína quimiotáctica monocítica -1 (MCP-1)62. Los niveles de AECAs aumentan en el suero de los pacientes con GW activa63-64. De estos sueros se han purificado los anticuerpos, los cuales se han estudiado in vitro, llegando a algunos expertos a excluir en algunas circunstancias su carácter citotóxico intrínseco, incluso en presencia de complemento65.
También se ha estudiado la participación de la inmunidad celular, con mecanismos de autoinmunidad bien definidos, que ayudan para la generación y perpetuación de autoanticuerpos, y la generación de citotoxicidad en forma directa66. En los granulomas del tracto respiratorio y a nivel glomerular, se identifican células T CD4+ y CD8+67. El aumento del receptor soluble de la IL-2, aumenta su concentración en sangre en pacientes con GW activa, lo que está en relación con un aumento de la inmunidad celular en estos casos68-69. Se ha demostrado in vitro la activación de las células mononucleares periféricas al exponerse a preparados purificados de MPO y PR-3, en pacientes “p” y c-ANCAs positivos70.
No hay consenso en la presencia de una asociación de la enfermedad con moléculas HLA clase II71-72. El polimorfismo de los receptores de fragmento Fcg de IgG (FcgR), puede ser factor genético que influencia la susceptibilidad a enfermedades autoinmunes e infecciosas73, que al ser investigadas en GW, se encontró un Riesgo Relativo de sufrir la enfermedad del 3.3 (95% de IC 1.6-6.8), en cuanto la presencia de individuos homocigotos para las formas R131 y F158 de Fcg RIIIa74.
Basados en lo anterior expuesto, un autor propone los siguientes modelos patogénicos de GW: 1- Los neutrófilos activados por citoquinas expresan PR-3. Los ANCAs reaccionan con dichos neutrófilos induciendo la producción de nuevas citoquinas que llevan a un efecto endotelial. 2- Las citoquinas estimulan las células endoteliales para la expresión de PR-3, induciendo la producción de ANCAs, los cuales se fijan y activan a los neutrófilos. 3- Los neutrófilos se activan, liberando PR-3 a espacio vascular, induciendo la producción de ANCAs, los cuales se unen a células endoteliales, generándose una reacción antígeno anticuerpo75.
Patología
La histopatología se constituye en el pilar diagnóstico de la enfermedad76, principalmente lo relacionado con las lesiones observadas en las biopsias transbronquiales y del tracto respiratorio superior, donde es evidente un compromiso inflamatorio granulomatoso necrotizante y la presencia de vasculitis77. Lo anterior aunado a la biopsia renal, donde se aprecia una glomerulonefritis. Las lesiones granulomatosas cursan por lo regular con necrosis central, y la obvia presencia de células gigantes de Langhans. A nivel de las arterias, venas y capilares se encuentra necrosis fibrinoide con infiltrado mixto polimorfonuclear y linfocitario79. Se pueden apreciar en el 9% de casos, granulomas en la pared vascular80. El parénquima pulmonar además de lo anterior anotado, presenta áreas de necrosis con bordes irregulares (aspecto geográfico), donde se pueden observar microabscesos y una reacción inflamatoria extravascular inespecífica. Se informan además los siguientes hallazgos: rinfiltrado con eosinófilos, hemorragia alveolar (característica prominente en algunos pacientes donde se confirma la ocurrencia de capilaritis)81, fibrosis intersticial, neumonitis por colesterol82, neumonía lipoídica y diversos cambios bronquiales como son la bronquiolitis necrotizante, bronquiolitis obliterante con neumonía organizada, granulomatosis broncocéntrica, bronquiolitis folicular y estenosis bronquial83-85. Es de anotar que ningún caso presenta todos los hallazgos anotados en un momento dado85. (Tabla 1).
Tabla 1 . Hallazgos patológicos en biopsias pulmonar abierta y de
vías respiratorias altas en pacientes con GW. Basados en Ref. 29.
| VARIABLE | LOCALIZACIÓN DE HALLAZGOS PATOLÓGICOS | ||||
| NASAL (n=60) |
SENOS PARANASALES LARINGE |
PULMÓN (n=82) |
|||
| (n=27) | (n=17) | ||||
| % | |||||
| CAMBIOS PARENQUIMATOSOS Necrosis geográfica Granulomas Microabscesos Microabsceso+granuloma |
20 47 33 20 |
56 59 37 33 |
18 23 18 18 |
68 59 65 68 |
|
| CAMBIOS VASCULARES Granuloma en vaso Vasculitis aguda Vasculitis crónica Necrosis fribrinoide Cambios cicatrizales |
7 17 23 10 0 |
15 30 30 11 4 |
0 0 6 0 6 |
Arterias 22 37 87 11 40 |
Venas 7 28 28 6 16 |
[spacer size=”10″]
En el riñón se aprecia una glomerulonefritis necrotizante segmentaria y focal en cerca del 80% de los pacientes. En el 8% se pueden encontrar cambios vasculíticos y en el 3% granulomas. Los estudios de Inmunofluorescencia revelan pocos depósitos de inmunoglobulinas y de complemento86-88.
Las lesiones de la piel consisten en vasculitis leucocitoclástica. Por la facilidad de obtener una biopsia de la mucosa nasal, algunos autores la han recomendado para fines diagnósticos80, 89-90. Se puede concluir que tiene bastante especificidad pero poca sensibilidad. Es de mucho valor si se logran encontrar las lesiones granulomatosas y vasculíticas, hecho que se presenta en el 23% de los casos29. Uno de los inconvenientes, es que se trata por lo regular de una muestra muy pequeña. La biopsia de mucosa de senos paranasales, presenta una situación similar a la biopsia de mucosa nasal.
Aspectos clínicos
Por lo regular el paciente inicia su enfermedad con síntomas generales, consistentes en fiebre, anorexia, pérdida de peso. La fiebre la presentan el 50% de los pacientes, y una pérdida de peso mayor del 10%, el 35% de los casos29.
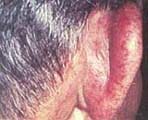
El compromiso del tracto respiratorio superior en algún momento de la enfermedad se da en el 92% de los pacientes29. Las quejas prominentes son síntomas a nivel de nariz, senos paranasales, oídos, sinusitis y rinitis que no ceden con tratamientos convencionales; drenajes serosanguinolentos, epistaxis, dolor nasal y ulceraciones dolorosas, son síntomas prominentes78. La otitis serosa media es la manifestación ótica más común, siguiéndole la pérdida auditiva de tipo conductiva por compromiso a nivel de trompas de Eustaquio, perforaciones timpánicas, lesiones de oído medio y condritis (Figura 1).
Figura 1. Condritis severa del pabellón
auricular en un paciente con GW.
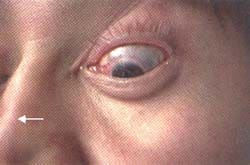
A esto se le suma la sobreinfección y el drenaje de material purulento78. La sobreinfección se debe principalmente a Staphylococcus aureus y menos frecuente a Pseudomona aeroginosa91. Es frecuente la resistencia a la antibioticoterapia. Algunos autores postulan que la presencia de Staphylococcus aureus es un factor determinante en las recaídas92. En estados más avanzados se desarrolla un daño irreversible en el tabique nasal con deformidad de la nariz en silla de montar91. (Figura 2)
Figura 2. Depresión en el tercio distal de la
nariz (flecha), secundaria a lesión del tabique.
Los tipos de compromiso traqueobronquial definidos por hallazgos broncoscópicos, son: estenosis subglótica (17%), traqueobronquitis ulcerosa con o sin pseudotumor inflamatorio (60%), estenosis traqueobronquial sin inflamación (13%), hemorragia sin fuente identificable (4%)93.
El tracto respiratorio inferior se compromete en el 85% de los casos, según hallazgos histopatológicos29. El espectro clínico va desde un 34% con compromiso asintomático, hasta un 17% que se considera severo con peligro para la vida29. Los síntomas más comunes son tos, disnea, hemoptisis y dolor pleurítico91.
Las manifestaciones renales se presentan más tardiamente que las anotadas en el tracto respiratorio. Consisten básicamente en hematuria, hipertensión arterial y edemas de diferentes grados. El 18% de los pacientes presentan compromiso renal, y de éstos el 70% lo desarrollan en los primeros dos años29. La progresión a formas severas puede ocurrir en pocos días94. La hipertensión arterial en general es poco común, incluso en formas renales severas94.
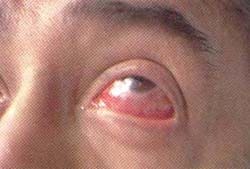
Las lesiones oftalmológicas en la GW se informan en el 40% de los casos91, y son ocasionadas por contigüidad de un proceso inflamatorio o como consecuencia directa del fenómeno vasculítico o autoinmune en las estructuras del ojo. Con respecto a la primera se encuentran la proptosis ocular (15 a 22% de los pacientes) secundaria a pseudotumor inflamatorio y celulitis orbital, causante de pérdida visual en el 8% de los casos95; la trombosis del seno cavernoso, la obstrucción nasolacrimal y la lesión de los músculos extraoculares95. Las lesiones intrínsecas del ojo son: conjuntivitis, epiescleritis, escleritis (Figura 3), ulceraciones corneanas, uveitis, lesiones de la retina y del nervio óptico (neuropatía óptica isquémica)29. Secundariamente se han informado la hemorragia vítrea y el glaucoma91.
Figura 3. Epiescleritis y escleritis en un paciente con GW.
Nótese la congestión de los vasos epiesclerales.
Desde el punto de vista musculoesquelético, las artralgias, artritis y mialgias se evidencian hasta en el 67% de los casos29. Las formas de presentación más comunes de artritis son la monoarticular y la poliarticular de grados moderados91.
El sistema nervioso se afecta en el 24% de los pacientes, siendo las manifestaciones más comunes las siguientes: lesiones cerebrales y de pares craneales por extensión a partir de senos paranasales, hemorragias intracerebral y subaracnoidea, lesiones directas de pares craneales, paquimeningitis, mononeuritis múltiple (en el 15% de los casos)29,91.
La piel presenta manifestaciones en el 46% de enfermos, en forma de púrpura palpable, lesiones ulcerosas, vesículas, pápulas y nódulos subcutáneos. En la boca podemos encontrar úlceras orales, lesiones en encías91.
A nivel cardíaco encontramos: pericarditis (6% de pacientes), vasculitis coronaria (12% de casos), con diversas formas de presentación (angina, infartos o arritmias)29.
Otros órganos que pueden presentar lesiones y por ende manifestaciones clínicas son: mama, próstata, tracto gastrointestinal, vulva, cérvix, uretra y parótida1, 29, 91, 96.
CLIC AQUÍ Y DÉJANOS TU COMENTARIO