Electroforesis de Afinidad para el Estudio de Glicoproteinas Séricas o Salivares
*Dr. Cristobal Cormdor
Summary
Affinity electrophoresis is a suitable physico-chemical analytical method for studying tire biology of serum and salivary glycoproteins. Usin a perplex of lucite template it was easy to study a three lectin diffusion patern of salivary glycoproteins in large ouchterlony plates, (simultaneous diffusion).
Ar orthogonal adjustable device for pounching and cutting tire agar or agarose gel as well as an electrophoresis chamber for horizontal planes for 26 samples were also designed.
This makes inmunoelectrophoresis and lectin affinity electrophoresis of glycoproteins easier reproducible and reduces time and cost.
Resumen
Metodología
La electroforesis de afinidad es un método de análisis físico-químico muy apropiado para estudiar el significado biológico de las glicoproteínas tanto séricas como salivales.
1.1 Aquí se ha diseñado un patrón de simetría geométrica (rosetas) para el análisis de las glicoproteínas salivares con tres teatinas simultáneamente (placas de Ouchterlony).
1.2 Un sistema Ortogonal para perforar y cortar el gel. Se da detalles de sus dimensiones así como de los procedimientos de la difusión simultánea y de la electroforesis (inrnunoelectroforesis) de glicoproteínas séricas o salivares.
1.3 Una cámara para la electroforesis de macromoléculas en placa horizontal, parcialmente refrigerada, con capacidad para 26 muestras (inmunoelectroforesis).
Las innovaciones instrumentales aquí especificadas permiten realizar los análisis clínicos de glicoproteinas en forma más rápida y aumentan su reproducibilidad y eficiencia. Se mencionan brevemente algunas aplicaciones clínicas de las lectinas en patologías humanas.
Introducción
Las glicoproteínas séricas y salivares son fenotipos bioquímicos resultantes de la expresión alélica de cada individuo. Las modificaciones postranscripcionales, especialmente las involucradas en la glicosidación de cada polipéptido, se ha venido comprendiendo cada día mejor gracias al empleo de fenómenos de bioafinidad o de reconocimiento específico entre lectinas (afinitinas) y sus receptores glicosídicos, en el laboratorio.
Las glicoproteínas séricas juegan un papel fisiológico muy importante en los mecanismos de defensa humoral y celular de los vertebrados. Adicionalmente y no menos importante, las glicoproteínas salivares desempeñan funciones protectoras de las mucosas orales ya como anticuerpos (Ig A), ya como factores bloqueadores o facilitadores de la adherencia de microorganismos cariógenos. (16,17,18,21) o no, ya como agentes antiabrasivos durante la masticación, (15), así como también en la preparación de los alimentos desde el punto de vista físico (humedad, temperatura), y químico (degradacción enzimática).
La heterogeneidad biológica de las glicoptoteínas salivares, en cada especie, es un factor fisiológico que determina la salud de un individuo y cada día reciben mayor atención. Se cumple el adagio popular: la salud y la “raza” entran por la boca.
En la biología tumural se ha venido descubriendo las asociaciones entre glicoproteínas y los procesos malignos. Algunos marcadores biológicos del cáncer toles como la alfa feto proteína (ATT) (8,26), han sido evaluados en suero ( 10). La electroforesis de afinidad ha sido evaluados en suero (10) La electroforesis de afinidad ha sido la herramienta ideal en estos casos para estudiar cuali y cuantitativamente estas glicoproteínas (3, 4, 5, 6, 13, 14).
Es preciso recordar, las afinitinas (A) son macromoléculas que tienen bioafinidad o reconocimiento específico por sus respectivos receptores (R). Estas bioafinidades pueden emplearse ya sea antes, durante o después de la separación electroforética de las glicoproteinas (7,22), para estudiar su microheterogeneidad química como se esquematiza.
A, B , C, = Glicoproteínas con determinantes; antigénicos específicos, sin actividad como lectina. Leonina a = teatina no glicoprotéica con alta especificidad hacia los azúcares de la glicoproteina A. Lectinas b y c = lectina; que presentan af’inides específicas para glicoproteinas B o C, o B y C. Ig** = Fragmento; F(ab)2 o F(ab) de origen mono o policlonal de alta especificidad. Sustrato = Reacción enzimática con coloración característica para visualizar un enzima glicoprotéica o no, o un anticuerpo especifico (contra una proteína o glicoproteína) pero previamente marcado con una enzima. Frank, Zisca 1981, Corredor 1987.
1-1 Lectinas:
La bioafinidad de las teatinas o fitolectinas (vegetal) por ciertos azúcares de las glicoproteínas, presenta un fenómeno biológico de reconocimiento biomolecular, similar al de la inmunoglobulinas con sus respectivos antígenos. Esta bioafinidad selectiva, sumada a las diferencias de densidad de carga eléctrica neta y a sus propiedades hidrodinámicas moleculares de las glicoproteinas en solución, hacen de la electroforesis de afinidad una técnica excelente en biología, para el estudio bioquímico, genético y fisicoquímico de biomolécular.
Las lectinas son proteínas o glicoproteínas extraíbles de una gran variedad de órganos como semillas, raíces, tubérculos, frutos, hongos, bacterias, moluscos, fluidos biológicos de vertebrados e invertebrados y de membranas celulares de mamíferos, (2,12). En la Tabla 1. se presenta las lectinas de origen Vegetal, las cuales poseen un amplio uso en biología.
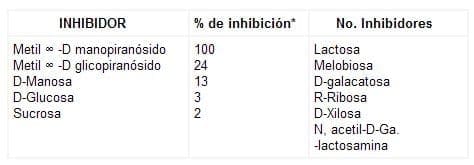
1.1.1. La concanavalina A, o Con A, cuyas características moleculares (bioquímicas, fisiocoquímicas y biológicas), han sido estudiadas detalladamente (2). La Con A tiene afinidad por azúcares libres o asociadas a polipéptidos (glicoproteínas), que presentan estructura molecular -D manopiranósidos o furanósidos o sus derivados, ya sean productos naturales o sintéticos (Ver Tabla No. 2 en Resultados y Discusión).
1.1.2. La PHA proveniente de semillas de fríjol rojo (Phaseolus vulgaris), es una glicoproteína tetramétrica que presenta cuatro isolectinas.
El homotetrámetro (PHA-L4) leucoaglutinante, presenta en un alto índice mitogénico comparado con el eritroaglutinante PHA-E4 (12). Este comportamiento biológico evidencia su amplio rango de bioafinidad por oligsacáridos. En este género de leguminosas existe una diversidad bioquímica de lectinas ya que al extraerlas del género .Phaseolus lunatus, estas presentan una bioafinidad diferente 1.1.3. Finalmente la lectina de semillas de Erithrina rubrinervia, leguminosa arbustiva de clima medio (fríjol chocho), presenta una bioafinidad hacia la D-galactosa y carbohidratos afines, Tabla 1, (20).
1.2 Ordenamiento
Se presenta:
1.2.1 Detalles de la extracción de las lectinas a partir de semillas secas.
1.2.2. Su uso en difusión simultánea, en geles.
1.2.3. Aplicaciones en electroforesis de afinidad. Finalmente se dan los detalles de la construcción de las cámaras para la electroforesis de las biomoléculas.
Materiales y Métodos
2.1 Metodología
La metodología comprende:
2.1.1. Toma de la saliva total humana sin estimulación siguiendo la técnica descrita por Corredor 1988 (9).
Cada muestra se trata a 56 °C durante 20 a 30 minutos inmediatamente después de tomada. Se clarificó por centrifugación (3.600 rpm x 15 min.)Almacenó a 10 °C hasta el momento de usar. Procuró evitar la congelación y descongelación repetidas de la muestra.
2.1.2. Obtención de antisuero total humano ( -STH) y suero antisaliva total humana (-SatH).
Como fuente de antígenos se utilizó una mezcla tanto de suero como de saliva de varios individuos ( >10) pertenecientes a los grupos sanguíneos A, AB, O, tomados cuidadosamente sin azida sódica y esterilizada por filtración. Se inocularon siete conejos albinos adultos y de aspecto sano, tanto para saliva como para suero, siguiendo protocolos ya establecidos (1 1,23). Cada conejo recibió diez inoculaciones subcutáneas dorsales, sin rasurar ni usar desinfectantes tópicos en la piel.
Cada semana se inyectó unos 2,5 mg de proteínas (calculada según Lowri). Al final de la 9a. o loa. inoculación, a cada conejo se le tomó una muestra de suero sangrándolo por la vena marginal de la oreja. Se midieron los títulos de anticuerpos en suero utilizando la técnica de inmunodifusión en placas de Ouchterlony (24-27). Aquellos ejemplares que presentaban arcos bien visibles y nítidos se volvieron a reinocular por dos semanas más utilizando la mitad de la dosis de adyudante completo de Freund.
Luego se sangraron totalmente (anestesiados) 7 a lo días después de la última inoculación, separando el suero por centrifugación (2.500 rpm x 15 min. ), el cual se almacenó a 4 °C añadiendo critales de NaN3 (0.02%).
* Dr. Cristobal Corredor Profesor Asociado Departamento de Medicina Oral y Cirugía, Facultad de Odontología – Universidad Nacional de Colombia; en comisión en el Instituto de Biotecnología Universidad Nacional de Colombia. Edificio Manuel Ancizar. Oí 2037. Tel: 2449948 – 32981M. Bogotá.
2.1.3. Aislamiento de lectinas.
Se tomo la fracción globulínica cotiledonar de cada especie de leguminosa, siguiendo la técnica publicada por Liener 1976 (2). Descascararon las semillas secas con una cuchilla y se dejaron secar más en nevera a 4 °C durante 8 días. Trituraron en un molino hasta obtener fragmentos medianos y se dejaron secar nuevamente en nevera durante 8 días.
Luego se pulverizaron en una “licuadora’ varias veces hasta obtener una pulverización fina. (Se evitó el recalentamiento de la harina durante la pulverización).
Se tomaron 100 gramos de harina y se le añadieron 400 ml de 1 M Nacl lo mM Tris-HCI pH 7,2 y 0,02% NaN3. Esta suspensión se dejó en agitación moderada a 4 °C durante la noche. Por filtración y centrifugación se tomó el sobrenadante al cual se le añadió ácido acético glacial, gota a gota con agitación moderada, hasta hacer el sobrenadante 1M.
Se dejó en agitación moderada durante 30 minutos a temperatura ambiente 18 °C. El sobrenadante se separó por centrifugación (3.600 rpm x lo min.) el cual se dializó en 10-15 litros de 0,9% NaCl; 0,1 mM MgCl2; 0,1 mM Cacl2 y 0,02% NaN3, hasta que el pH de la solución dializadora fuese cercano a pH 7.0.
Nuevamente se aclaró por centrifugación y se dejó a 4 °C. Esta preparación se podría clarificar aún más pero para usos prácticos en la electroforesis de afinidad este tratamiento es suficiente. Estas preparaciones deben ser tituladas según metodología publicada por Corredor 1988 (9).
2.1.4. Difusión en placas de Quchterlony
A cada preparación de lectina se tituló por difusión en geles, frente a una mezcla de glicoproteínas séricas o salivares. Sobre una lámina de vidrio (10x7x0.2 cm) perfectamente nivelada se depositaron 25 mL de 1% agar; 0,9% Nacl; 0,02% NaN~; 0,1 mM amortiguador borato pH 8,3. El gel se perforó utilizando un patrón de simetría geométrica (rosetas) con huecos de 4 mm equidistantes unos de otros 4 mm.
Cada hueco posee una capacidad de 20-30 uL de muestra. El gel una vez sembrado con las muestras según protocolo preestablecido, se dejó a temperatura ambiente 20-30 horas para que se efectúe la difusión (11, 24). Con esto se obtuvieron la tipificación o titulación de lectinas frente a suero o saliva, ver Figura 6 en Resultados y Discusión.
2.1.5 Patrón de simetría múltiple.
Para los análisis de rutina en saliva, se utilizó el mismo principio de difusión en geles descrito anteriormente pero utilizando proporciones óptimas de (as tres lectinas en forma simultánea. Para esto se construyó el patrón de simetría geométrico múltiple. Con una broca de 4 mm de diámetro se perforó una lámina gruesa de cristacril o lucita de 1,5 cm de espesor, (25×14 cm), tomando como centros de perforación los vértices de triángulos equiláteros de 9 mm de lado.
Se trazó el máximo número de triángulos contiguos. De esta manera los huecos quedan alineados en tres direcciones: Horizontales, verticales (ortogonales) y oblicuas (60°). Esta propiedad facilita la aplicación sistemática de las lectinas, según se esquematiza para una placa con capacidad para 56 muestras con 25 filas (impares) de 7 huecos cada una.
Utilizando esta distribución en lineas (hileras) primero se coloca las lectinas (20 uL/hueco), según el esquema preestablecido con un ciclo básico así: Ph. 1 = hilera 1; saliva = hilera 2; Ph v = hilera.3; Con A = hilera 4; saliva = hilera 5; Ph v = hilera 6. En la hilera 7 se vuelve a repetir el ciclo. Para visualizar la posición de cada lectina se añadió un colorante >inerte previamente a la siembra, como indicador de la posición de aplicación.
Aquí se utilizó el rojo de fenol y el azul de bromofenol (pg/mL).
Considerando que en este patrón de simetría, cualquier hueco está rodeado de seis huecos equidistantes (roseta), se colocó primero la Con A en las hileras correspondientes marcadas con los números I, II, III, IV, V, VI, VII, y VIII (Fig. 3). Con esto se consigue que cada hueco, componente de estas hileras, sean centros de rosetas o identificables como AI, BI, Cl, DI, El, FI, y GI, AII, BIT, CIT, EII, FII y GII, etc. Así las muestras de saliva (o suero) ocuparán una posición triangular en cada roseta.
(Ver figura 7). Por cada persona se sembraron dos muestras lo cual da una capacidad de siete personas por hilera con un total de 7×8 = 56 personas por placa.
2.1.6. Proteínas totales por el método de Lowri.
Adaptado para pequeños volúmenes (2). A 50-70 uL de la saliva, suero o lectina (FGC), se diluyó con solución salina a un volumen de 0,8 mL. Luego se añadió 2 mL del reactivo C; éste está compuesto de 50 mL del reactivo A (2fé NaCO~ en 0,1 N NaOH), más 0,5 mL del reactivo B = (0,5fé CUSO~ SH~O; 1fé citrato de sodio).
Se dejó reposar la muestra durante lo minutos para luego añadirle 0,2 mL del reactivo de Folin Ciocalteau (densidad 1,22 Merck, diluido al 50% en agua), cuidando de homogenizar bien. Se dejó reposar 30-40 minutos y luego en el fotocolorímnetro se registró la intensidad del color, (azul morado) con filtro rojo o rojo púrpura, o con un = 750 mm.
Debe preparar una curva de calibración con una proteína patrón ya que el color de Folín no es estrictamente proporcional a la concentración de las proteínas en la muestra. El suero humano o la albúmina sérica bovina cristalizada, pueden ser utilizados para tal fin.
Al utilizar equipos que requieran volúmenes mayores, o menores se deben conservar las proporciones de los reactivos.
2.1.7 Construcción de la cámara para electroforesis (placa horizontal).
Se diseñó la cámara con material plástico (cristacril o lucita) para geles en placas (14x14x0~3 cm) con capacidad para 26 muestras. Los geles tanto de agar como de agarosa se moldearon sobre placas de vidrio niveladas perfectamente. Estas mismas placas se traspasaban a las cámaras de electroforesis las cuales volvían a quedar niveladas, (11, 24, 27).
Material: cristacril o lucita pegado con cloroformo. A: Corte longitudinal con detalles de los tomillos laterales T, y el punto P, para la nivelación. Esto permite tener una capa líquida del bufer (electrodos) sobre el gel. Obsérvese así mismo que el gel descansa sobre una cámara refrigerada por agua con entrada El y salida E2. Los electrodos e., de alambre de platino, están enrollando en espiral sobre un cilindro de lucita de 9 mm de diámetro. B: Vista superior de la cámara; C:I posición de trabajo. II posición invertida.
2.1.8 Construcción del perforador, cortador del gel.
Se diseñó un sistema ortogonal compuesto por: Un puente sobre el cual se ajusta tanto el perforador como el cortador (tipo arado) del gel, una plataforma portaplaca desplazable en forma gradual (5 mm)
Material de Lucita o Cristacril. A: detalles de construcción de cada una de sus panes. B : Vista en perspectiva. e: Soporte puente. f: Guía deslizable sobre la varilla V, ajustable con los tornillos T1 (de teflón). T2: Tornillo fijador de la guía . T3: Tornillo guía del tubo perforador (sacabocado del gel) éste está perforando (no indicado) con distintos diámetros (4mm 1,2 mm), según el tipo de perforación requerido. T6: Pivote soporte para cortageles tipo arado. L1, L2 y L3: Levas graduables para determinar la longitud y posición de las ranuras sobre el gel (porta afinitinas). T5: Tornillos sujetadores del puente sobre una placa horizontal de lucita (74x25x0,3 cm). C: Detalles de construcción del cortador del gel (ranura) tipo arado. a: cuerpo metálico del arado, b: gancho (acero inoxidable) removedor del gel. c: cuchillas (inox cortadoras del gel. d: tomillos sujetadores del gancho y cuchillas.
2,1.9. Electroforesis de afinidad.
Esta técnica comprende dos pasos. Primero, se separan las macromoléculas porta receptores (R), ya sean antígenos o glicoproteínas, según su carga eléctrica neta y propiedades hidrodinámicas y segundo, se hacen reaccionar con sus respectivas afinitinas (A) (Fig. 2) pasos III y IV; III – I y V, (6).
El gel de migración está compuesto de agar o agarosa al 1% en amortiguador borato o Tris-barbital.
2.1.10. Borato al 1% ; fuerza iónica 0,05; pH 8,6; (6,79 g H3B04;13 g Na2B40710H2O disueltos en un litro de agua.
2, 1.10.1. En el método de Laurell se recomienda el amortiguador tris barbital, fuerza iónica 0,02 pH 8,6 (Acido dietil barbitúrico o barbital 224 g; Tris 443 g; NaN3 8 g; Lactato de calcio 20 g disueltos en lo litros de agua). Al usarlo se diluye 1 parte de solución madre más 4 panes de agua (24). En los tanques de los electrodos se utilizó amortiguador borato al 12% o tris-barbital diluido 1:4, (27).
Para sembrar las muestras se perforan huecos de 4 mm (para 20 uL de saliva) o 1,5 mm (para 5 uL de suero diluido 1:9). La siembra se hizo lo más rápido posible para evitar la difusión radial de la muestra dentro del gel (Fig. 8A y B de resultados) (27). Las corridas electroforéticas se realizaron por el sistema convencional de placa horizontal, (o sumergida en el amortiguador, bien nivelada) controlando el tiempo de corrida con albúmina sérica marcada con azul de Evans (11, 24, 27).
Al terminar la electroforesis se hicieron sendas ranuras paralelas a la dirección de la corrida, con el cortador de geles tipo arado 1,7 mm de ancho, Fig. 8 C y D, para luego llenarlas con un volumen de 0,2 mL de la afinitina correspondiente, para que por difusión se formen los arcos de coprecipitación. Alternativamente se pueden dejar las placas de agar sumergidas en aceite mineral durante el tiempo dela difusión a temperatura ambiental.
Una vez formados los “arcos” de coprecipitación en el gel, como producto del reconocimiento, (entre la lectina respectiva y su receptor), se fotografió directamente el gel utilizando iluminación indirectá, (campo oscuro) (11, 27).
Los componentes protéicos no reaccionantes (en la inmunodifusión) se removieron dejando las placas sumergidas en 0,9% Nacl 0,02% NaN3 durante 36 horas. Alternativamente la placa se humedeció con solución salina; luego se le coloca papel de filtro también húmedo y sobre este se coloca en varias capas ( z 1 cm de espesor) de papel seco absorbente (papel toilet blanco), sujetándolo con una lámina de vidrio (14x14x0,3 cm).
Se dejó absorber durante 3 horas. El gel se secó con una corriente de aire caliente (para tinción de proteínas totales) o con aire frío (para tinción enzimática) (1 1, 24, 27).
Para visualizarlas”bandas o arcos” de coprecipitación, los geles se sumergieron en 100 mL de solución colorante (azul ce Coomassie R-250 50 g; etanol 4,5 L; ácido acético glacial lL; agua destilada 4,5 L), durante 10-20 minutos (11, 19, 27). Luego se removieron los geles y se lavaron brevemente con agua para luego dejarlos sumergidos en tres litros de: (Etanol 4,5 L, ácido acético glacial 1 L, agua destilada 4,5 L) durante 24 horas.
Esta solución se puede reutilizar pasándola por un filtro con carbón activado para remover el colorante. Después que los geles quedaron lavados se secaron con una corriente de aire o en una estufa 40 °C para fotocopiarlas por contactu con películas o papel de bajo contraste.
Resultados y Discusión
3.1. La difusión en placas de Auchterloni de lectinas y glicoproteínas.
El empleo de lectinas pretipificadas, Corredor 1988 (9), requieren una posterior titulación por difusión en geles (Fig. 6) para dar confiabilidad al comparar por difusión simultánea varios individuos, frente a una sola lectina. El precipitado que se forma en el gel en forma de líneas, (nubes), es el resultado de la bioafinidad entre la lectina (di o tetravalente) y los carbohidratos accequibles (receptores, polivantes) en las glicoproteínas.
Por lo tanto la relación óptima de cada lectina para cada especie de glicoproteínas depende de la naturaleza química del carbohidrato y de las interrelaciones espaciales de éstos dentro de la estructura cuaternaria de cada glicoproteína.
La difusión en geles excluye macromoléculas salivares de alto peso molecular incapaces de migrar dentro del gel. Individuos negativos para ciertas lectinas puede obedecer al hecho de que algunas glicoproteínas, (musinas), aunque solubles presentan fuertes asociaciones intermoleculares que les impide migrar por difusión dentro del gel. Esta característica sumada a las variaciones biológicas glicoprotéicas reducen la utilidad de la difusión en geles.
Es de advenir que con esta metodología no se puede garantizar que se estén analizando la totalidad de las glicoproteínas séricas o salivares en solución ya que algunas glicoproteínas no presentan afinidad por las lectinas correspondientes. Obviamente la presencia-de trazas de carbohidratos libres en la saliva entrarán a competir con los respectivos receptores glicosídicos de las glicoproteínas inhibiendo la formación de conglomerádos visibles.
Al analizar por el método calorimétrico de Lowry el contenido de proteína en el complejo lectina/glicoproteína formado directamente en medio líquido, se puede establecer la relación óptima de cada lectina, tanto para suero como para saliva (9).
En el caso particular de la Con A, el análisis de azúcares totales por el método de fenol-ácido sulfúrico (2), fue el indicado para cuantificar las glicoproteínas séricas o salivares reaccionantes, ya que la Con A es de naturaleza protéica solamente. (2). Las lectinas de Ph. Vulgaris, Ph lunatus que son de naturaleza glicoproteíca se dificulta el análisis por azúcares totales en el coprecipitado. Si en los experimentos de tipificación de cada lectina (por coprecipitación sedada de líquidos y en geles) no presentó una formación de precipitado proporcional al volumen de la preparación de cada lectina se procedió a concentrar la preparación.
Para esto se dejó la preparación en una bolsa de diálisis dentro de la nevera a 4°C por varios días. Después de esta concentración se dializó la preparación con solución salina isotónica (0,9% NaCl 0,l mM Cacl, 0,1 mM Mgcl2 0,02% NaN3) para reiniciar los ensayos de tipificación.
“A”; y el sobrenadante por difusión complementaria en geles “B”. Aquí el sobrenandante o fracción no coprecipitada se coloca en hilera de huecos (n), paralela a una hilera inferior en donde en forma alternada se coloca la afinitina (A) y su receptor (R). La inclinación de la línea de coprecipitación en la parte superior del gel, nos indica si teníamos en el sobrenadante exceso de receptor (1) o exceso de afinitina (n).
Existe un punto (nx) en el que el sobrenadante no presenta ni afinitina ni receptor disponibles. “C”. Difusión simultáneas en geles de dos afinitinas, Con A y PhA vs glicoproteínas séricas dando arcos de coprecipitación simultánea, “D”. Obsérvese que en las pruebas de difusión en geles siempre se usa un patrón de simetría en forma de triángulo equilátero (5 mm de lado). Los huecos pueden recibir de 5 a 30 ul de muestra según el diámetro y espesor del gel. So and Goldstein 1967, Swell 1967, Corredor1990.
Es de anotar que la técnica de “difusión” en geles no permite un análisis diferencial de los componentes salivares o séricas interpersonales dado el bajo poder resolutivo del método. También aquí, como en líquidos, los arcos de coprecipitación no se presentan en la totalidad de las glicoproteínas reaccionantes entre las lectinas.
Y sus receptores ya que algunos complejos lectina-glicol péptido no forman coprecipitados visibles, dada su alta hidrofilicidad, salvo si son tratados previamente con calor, o se colorean con sustancias afines a las proteínas (negro amida, rojo punceau, azul de coomasie, etc.) (2,11, 19, 24, 27).
Para demostrar la especificidad en la bioafinidad de cada lectina por los carbohidratos, Goldstein 1976 (2) comprobó el poder de inhibición de varios carbohidratos sobre la unión de la Con A con glicoprotíenas, (tabla 2) encontrando un rango estrecho de afinidades según la estructura química glicosídica del inhibidor, (competencia).
3.2 Difusión Simultánea.
La difusión de macromoléculas en un sistema gel o placas de Auchterloni permite detectar simultáneamente bioafinidad de dos o tres lectinas por sus receptores (polivalentes), presentes en cada glicoproteína sérica y salivar.
Aquí tanto la lectina como las glicoproteínas se difunden por los poros del gel radialmente a partir de sus puntos de aplicación (siembra). Perforando el gel utilizando el patrón de simetría geométrico (Fig. 3) se asegura que la distancia de migración por difusión fuese igual para todos y cada uno de los participantes en el fenómeno de reconocimiento específico.
Para cada lectina, si el receptor en cada una de las distintas glicoproteínas posee estructuras moleculares similares o idénticas (química y propiedades hidrodinámicas), su encuentro producirá una línea más o menos recta o semicurva, en forma análoga a las que producen la unión entre un anticuerpo y sus antígenos (11, 24, 27).
El tamaño de esta línea de “reconocimiento” dependerá de las concentraciones relativas de cada uno de los elementos reaccionantes.
La presencia de más de una línea o banda de precipitado nos indica que las glicoproteínas o poseen tamaños moleculares diferentes o reasociaciones que afectan sus propiedades hidrodinámicas. Si dos sistemas contiguos son iguales o equivalentes en su asociación de lectinas glicoproteínas, las líneas de coprecipitación forman un polígono de líneas continuas, (triangular, hexagonal) indicando una reacción de identidad o similitud.
Esta reacción es homóloga a la reacción antígeno-anticuerpo en inmonudifusión. Una placa de difusión simultánea de glicoproteínas salivales de 56 donantes. Aquí el 5ib de los individuos presentaron una reactividad con Pb. vulgaris y Pb lanatus. El significado biológico de esta reactividad (bioafinidad) es un estudio en progreso.
En un estudio anterior de glicoproteínas de reserva (FGC) de cinco variedades de fríjol (Pb. vulgaris) se pudo observar que: Con A detectaba tres grupos de glicoproteínas séricas: arcos A1, A2 y B mientras que con la FGC sólo detecta dos arcos a y b. El arco a forma unión de “identidad con los arcos Al y A2 del suero humano. La PHA de la FGC de las cinco variedades a su vez reconocen dos grupos de glicoproteínas séricas humanas, un bp es “idéntico” a b de la Con A, y el otro bs es “idéntico” a “B” del suero.
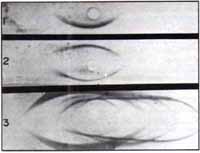
(Sa) que reaccionaron con las lectinas Ca navalia ensiformis (Con A), Phaseolus lunatus (Ph.1) y Phaseolus vulgaris (Ph. v), formando líneas o bandas de coprecipitación positiva como en la roseta No. 1 el 95% de las glicoproteínas salivares no reaccionó con las lectinas.
En la roseta No. 2 se observa reacción positiva en saliva de pacientes con gingivitis (después de un cepillado normal y en la No. 3 reacción de saliva de un paciente dos días después de aplicados correctores metálicos (ganchos-brackets). La presencia anormal de glicoproteínas séricas en la saliva podría explicar la positividad de la reacción con las lectinas.
3.3. Electroforesis de afinidad.
Los diseños tanto de la cámara de electroforesis (Fig. 4) como del perforador cortador (ortogonal) de geles (Fig. 5) ha permitido adelantar estudios poblacionales de glicoproteínas séricas, salivales humanas o cotiledonales de fríjol (Fig. 8). La nivelación del gel ha permitido realizar las corridas electroforéticas manteniendo el gel sumergido en el amortiguador de los electrodos.
Así se ha eliminado el efecto mecánico sobre el gel cuando hay endosmosis (agar). Al comparar geles de agarosa y agar en geles sumergidos se comprobó que la albúmina sérica bovina marcada con azul de Evans (11 ), migraba mejor y más rápida en agarosa, (Fig. 9).
Fig. 8: Perforación y renovado del gel.

en gel sumergido (14x14x0.2 cms) tanto de agar (óxid) como de agarosa (Merck, Littex).
Esta metodología se ha venido promoviendo entre los estudiantes de biología médica para estudiar los componentes glicoprotéicos salivares o séricos.
Una vez obtenidos los anticuerpos policlonales en animales hiperinmunizados (11) y aisladas las gamma globulinas siguiendo las técnicas de Steinbuc y Audran 1964 (25) se pudo demostrar como las lectinas del fríjol Ph vulgaris (PHA) podría coprecipitar del suero humano solo glicoproteínas de movilidad gamma (Fig.10). Esta metodología podría refinarse aún más si complementáramos el estudio utilizando anticuerpos monoespecíficos (tipo anti Ig A, Ig G, etc.). Para ir precisando cuales antígenos glicoproteícos que tienen idéntica movilidad están presentes en estas zonas de baja movilidad (11, 23).
Una aplicación clínica importante de esta metodología es la de poder concentrar antígenos glicoproteícos séricos o salivales usualmente presentes en muy bajas concentraciones en estos fluidos biológicos. Además, utilizando lectinas específicas para varios tipos de carbohidratos (tabla 1) se podría discriminar cualitativamente el patrón de glicosidación protéica tanto en fisiología como en las evoluciones patológicas de la cavidad oral.
A: Sistema ortogonal o cartesiano en el que el perforador (p) se desliza sobre sus guías Gl y la placa (p) sobre su guía G2, en pasoss graduables (5 mm). B: El gel perforado (puntos de aplicación de la muestra). Obsérvese la remoción del trozo del gel con una aguja hipodérmica. C: Ranuración del gel por medio del portador (a) tipo arado el cual se desliza sobre su guía G2 tal como se ilustra en D.
(1% de agar, amortiguador barro pH 8,3) en presencia de sucrosa al 1%. Coprecipitación selectiva de glicoproteínas séricas (casos 1, 2, por la PHA de Ph vulgaris. El coprecipitado una vez aislado y lavado (9) fue disuelto con oligosacáridos: sacarosa lfé, glucosa lfé pH 2.5). Obsérvese la movilidad electroforética tipo gamma (25), Caso 3 inmunoelectroforesis de antígenos séricosa humanos totales.
3.4 Aplicaciones Clínicas de las lectinas
Al combinar la especificidad molecular de los anticuerpos con la afinidad de las lectinas por los azúcares de las glicoproteínas, prácticamente se podrían estudiar las variaciones bioquímicas cuali o cuantitativamente en la mayoría de los sistemas biológicos (6, 7, 13). Alroy et al 1984 (1), utilizando cuatro lectinas caracterizó histoquímicamente en la -fucosidosis humana como positiva para Con A, WGA y PNA. La sialosidosis humana como positiva para Con A, WGA y SWAG. En la B-manosidasa caprina fue negativa para las lectinas anteriores.
Empleando las lectinas Con A = Canavalis ensifonnis; WGA = Thticum vulgaris; UEA = Ulex europea; PNA = Arachis hypogea. Estas afinitinas estaban marcadas con un visualizante complejo: Avidina biotina – peroxidasa).
Adaptado del Alroy et al 1984; J. Histod Cytochem. 32(12): 1280-4.
Ching y Rhodes 1988, (10) utilizando la transferencia electroforética de las proteínas de los geles de poliacrilamida a hojas de nitrocelulosa y empleando la PNA marcada con 1-125, demostraron la presencia de una glicoproteína sérica de alto peso molecular ( 3,5 x 106 D) en 12 pacientes de 34 casos de cáncer de páncreas estudiados. Dicha glicoproteína sérica no se encontró en ninguno de los 96 donantes controles lo cual sugiere que esta glicoproteína podría ser un marcador biológico de cáncer del páncreas.
Breborowicz, Mackiewic y Breborowicz (8) estudiando la microheterogeneidad (22) biológica de la alfa feto proteína (AFP), por los perfiles electroforéticos pudo diferenciar los tumores primarios hepáticos de las matastasis hepáticas utilizando las lectinas Con A y LCA (Lens culinares). En estudios similares Takedo y colaboradores 1983 (26) pudieron caracterizar este marcador oncológico, en cuatro especies moleculares: La AFP, no reaccionante con Con A, LCA-A ni LCA-B.
La AFP3 presentaba una alta afinidad con A pero muy baja afinidad con LCA-A, La AFP3 presentaba una afinidad fuerte por las tres lectinas y la AFP4 que solo se manifestaba como trazas en los hepatomas, presentaba afinidad por LCA-A y LCA-B pero no con Con A, (4). Estas glicoproteínas presentaban movilidades electroforéticas relativas todas iguales cuando no se empleaban lectinas.
Irimura, North y Nicholson 1987, (14) pudieron estudiar por electroforesis (SDS-PAGE) algunas glicoproteínas de membrana en macrógrafos activados por diferentes métodos. La lectina PWM-P4 (Phytolacca americana), que presenta afinidad por ramificaciones glicosídicas tipo pali (N-acetil galactosamina) podría ser un marcador de membrana de los primeros estudios de activación de macrófagos.
Bibliografía
4. 1. ALROY, J. et al 1984. Identification of glycoprotein storage diseases; J. Histch. Cytochem. 32 (1): 1280-4.
4. 2. Bittiger H and HP Schnebli, 1976. Concanavalin A as Tool. Edit. John Wiley and Sons, New York U.S.A. pp 639.
4. 3. Bog-Hansen T. C, OJ Bjerrum and J. Ranlau. 1975. Detection of biospecific interaction during first dimention electrophoresis; in: Crossed Imrnunoelectrophoresis; Scand. J. Immunol 4 suppl, 2: 141-7.
4. 4. Bog-Hansen T-C, and C. H. Brogen 1975. Identification of glycoproteins with one and with two or more binding sites to Con A by crossed immunoafindelectrophoresis; Scand J. Immunol 4 (2): 135-9.
4. 5. Bog-Hansen T-C- and K. Takedo 1980. Determination of dissociation constans by affinity electrophoresis: Complexes between human serum proteins and concanavalin A; Electrphoresis 1: 67-71 .
4. 6. Bog-Hansen T-C, and O-J- Bjerum and C H Brogren 1977. Identification and quantification of glycoproteins by affinity electroforesis; Anal Biochem 81: 78-87.
4. 7. Bog-Hansen T-C, 1983. Affinity electrophoresis of Glycoproteins; in: Solid Phase, Biochemistry, Analytical Sinthetic Aspects; Edt John Wiley and Sons Inc. p – 223-51.
4. 8. Brevorowicz J. A. Mackiewicz and D. Brevorowicz, 1981. Microhetrogenity of alfaetoprotein in patiens serumas demostrated by lectin affino-electrophoresis. Scan J. Immunol 14: 15-20.
4. 9. C.Jrredor, C. 1988. Glicoproteinas salivares; Odontológica Maxilofacial, SCCOMF, No. 3: 9-18.
4.10. Ching Ch K and J. M. Rhodes 1988. Identification and partial characteriaction of a new pancreatic cancer related serum glycoprotein by SDS-polyacrilamide gel electrophoresis and lectin blotting ; Gastroenterology 95 ( 1 ) : 137-42.
4.11. Crowle A-J- 1973. Immunodiffusion. Edt Academy Press, New York U.S.A. pp 545.
4.12. Hemández F. y C. Corredor 1985. Contenido de eritroaglutininas (PHA-E) en semillas individuales de Phaselus vulgaris: Metodología XX Congreso Nacional de la Asociación Colombiana de Ciencias Biológicas. Bogotá, Octubre 10; comunicacion pp 11.
4.13. Horesi V, et al 1982. Affinity Electrophoresis: NewSimple and General Methods of preparation of affinity gels; Anal. Biochem, 125: 358-69.
4.14. Irimura, T. S. M. North and G. L. Nicholson, 1978. Glycoprotein profilis of macrophage at differents Istages of activation as revealed by lectin binding after electrophoretic separation; Eur. J. lmmunol. 17: 73-8.
4.15. Levvine M. J. et al 1987. Funtions of human salivaand salivary mucins: An overviw in Oral Mucosas Diseases Biology Etiology and Therapy. Ed. Dows Institute For Dental Research by Laegeforenin gensforlag, July 1987, p 24-7.
4.16. Levine M. J., et al 19781 Specifity of salivary bacterialinteractions: Roll of terminal sialic-acid residues in the interaction of salivary glycoproteins with Streeptococcus sanguis and Stretococcusp mutans: Inf. Immunit 19(1): 107- l 5.
4.17. Murray, P-A- et al. 1982. Specificity of salivary-bacterial interactions: II Evidence for a lectin on Streptococcus sanguis with specificity for a New Ac 2, 3Gal BI, 3 Gal NAC, sequence; Bioch; Bioph. Research. Comm; 106 (2); 390-6.
4.18 Mccabe MM and EE Smith, 1976. Carbohydrate receptors for oral Streptpcpcci;in: Inmunologic Aspects ofDental Caries. Edtlnformation Retrievallnc. Arlinton; p 101-1 lo
4.19. Nerenberg, S-T- 1968. Electroforesis. Edt. Jims, Barcelona España pp 269.
4.20. Peña, C. FF. Villarraga and G. Pérez 1988 A Lectin from the seed of Erithrina rubrinervia: Phytochem. 27(4):1045-8.
4.21. Sharom N, 1987 Bacterial lectins; Cell-cell recongnition and infectius disease; Fed. Eur. Bioch. Soc. 217(2): 145-57.
4.22. Soderholm J, and C. J. Smyth, 1975. Crossed inmunoelectrofocusing for studies on protein microheteorgenity; in: Progres in Isoelectric Focusing and Isotachophoresis. Edt. North-Holand Publishing Co. P, 99-114.
4.23. Shneider W. y H. Bemd 1973. Inmunoelectroforesis; Edt. Panamericana, Buenos Aires – Argentina, pp 93.
4.24. Svenden P. J. B. Weeke ana B. G. Johansson , 1985. Chemicals, Solucions, equipment ana general procedures, Scand. J. Immunol. 17 (supl lo): 3-20.
4.25. Steinbuch M. et R. Audran. 1969. Isolement de Linmunoglobulin Ig G du plasma humain a l’ aide de l’ acide caprilique; Rev. Ftánc. Etudes. Clin Biol, 14(10): 1054-8.
4.26. Taketa, K;~M. Izumi ana E. Ichikawa. 1983. Distint molecular species humans fetoprotein due to diferential affinities to lectins; Ann. New York Acad Scienc. p. 61-68.
4.27. Weeke, B. 1973 General remarks on principies equipment reagents ana procedures. Chapter 1,2; in: Quantitative Electrophoresis; Scand. J. Immund (Sup 1): 1-56.
El autor agradece la colaboración de la señora Patricia A. Ochoa por su colaboración en el trabajo de laboratoño. También a D-C- Corredor y F. Corredor por los esquemas y diagramas así como a J-P- Barbosa por su ayuda y corrección del trabajo en el taller de mecánica. A los estudiantes de Odontología de la Universidad Nacional de Colombia por su aporte y entusiasmo en el presente trabajo.





CLIC AQUÍ Y DÉJANOS TU COMENTARIO