Desarrollo e Investigación Clínica de un Medicamento
Rincón Epidemiológico
PARTE I
Jairo Andrés Martínez, Md. Médico Cirujano, Universidad El Bosque, Postgrado En Farmacología, Universidad Nacional De Colombia, Asesor Médico – Jefe De Farmacovigilancia Cs&E, Dirección Médica. Novartis De Colombia S.A.
La necesidad de realizar investigación de nuevos medicamentos es de trascendental importancia para el desarrollo de la humanidad.
Según la Organización Mundial de la Salud (OMS) hasta la fecha, todavía no existen tratamientos adecuados para tres cuartas partes de las dos mil quinientas afecciones médicas reconocidas en la actualidad.
La investigación de nuevas sustancias terapéuticas en el siglo XX, ha contribuido a una disminución considerable en la mortabilidad. Por ejemplo se han reducido a 80% las muertes por causa de enfermedades infecciosas, 75% por enfermedades reumáticas, 68% por arteriosclerosis, 67% por hipertensión arterial y en 61% por causa de enfermedades ulcerosas.
La pasión y dedicación de los investigadores de grandes equipos de trabajo, sumado a muchos años de inversión en diferentes lugares del planeta, ha permitido que los avances terapéuticos sean utilizados en bien de la humanidad.
El desarrollo de un nuevo medicamento es una gran empresa, la cual parte desde el momento de seleccionar una o dos posibles moléculas candidatas para desarrollo, dentro de diez mil potenciales con acción terapéutica.
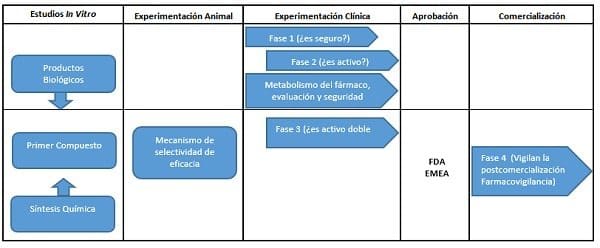
Una vez escogida la molécula, se prepara el proyecto de investigación que se inicia en el laboratorio. Con un período preclínico que incluye los estudios sobre síntesis química, análisis de impurezas. Estabilidad en relación el compuesto o las posibles formulaciones a administrar, proceso conocido como experimentación in vitro.
La investigación continúa en animales de experimentación, realizando ensayos con el candidato a medicamento:
Se evalúan los procesos de absorción, matabolismo y excreción con sus correspondientes análisis farmacológicos y toxicológicos, los cuales se realizan con estándares éticos, de calidad y de investigación. Una vez aprobados satisfactoriamente, se continua al período clínico o de investigación en humanos.
El período clínico consta de varias partes: la fase l o de farmacología humana, en la cual se realiza la investigación del medicamento estudiando su comportamiento en un estudio con voluntarios sanos seleccionados, usualmente de 20 a 100 individuos; busca establecer la seguridad del medicamento, farmacocinética y farmacodinamia.
El diseño de estos estudios es abierto, por lo general simple o doble ciego con una duración promedio de nueve a 18 meses. Se hace excepción en medicamentos que se encuentren en investigación para el tratamiento del cáncer y el SIDA con el fin de acelerar su desarrollo, ya que son patologías consideradas prioritarias porque requieren nuevos y mejores tratamientos.
La fase ll de investigación clínica o exploración terapéutica establece eficacia, indicaciones, dosis, mecanismo de acción, seguridad y farmacocinética en dosis múltiples; los estudios son aleatorizados, doble ciego, controlados con placebo o fármacos de referencia (innovadores). Se incluyen de 1.000 a 3.000 pacientes, los criterios de inclusión y exclusión son menos estrictos y su duración es de uno a cuatro años.
Completando todas las fases con resultados satisfactorios, se solicita la aprobación para el nuevo medicamento a las autoridades reguladoras, como la Administración de Alimentos y Medicamentos en los Estados Unidos – Food and Drug Administration (FDA) o a la Agencia Europea del Medicamento (EMEA), proceso que dura en trámite entre 12 y 24 meses.
Con un medicamento aprobado para su comercialización:
Continúa la investigación clínica en fase lV, de uso terapéutico o de postcomercialización, con una muestra de más de 5.000 pacientes, donde se establecen nuevas indicaciones, formulaciones o vías de administración, además la efectividad y seguridad en grupos especiales, siempre en condiciones reales de la práctica clínica.
Por lo general el diseño es aleatorizado, doble ciego, controlado con fármacos de referencia. También se realizan estudios observacionales durante el tiempo que dure el medicamento en el mercado.
Además, se continúa con la farmacovigilancia de la molécula, haciendo el seguimiento mediante el reporte espontáneo de los potenciales eventos adversos que se puedan presentar en condiciones habituales de la práctica clínica, otra gran herramienta para la investigación clínica en la situación real de uso y con un mayor número de pacientes expuestos a la molécula.
Figura 1. Procedimiento de desarrollo de un medicamento. Algunos requerimientos pueden ser diferentes para fármacos de enfermedades que amenazan la vida (Adaptado de Farmacología Integrada, 1ª ed., por Page, Harcourt Brace.)
Todas las fases de investigación clínica farmacológica se realizan bajo los parámetros de la Buenas Prácticas Clínicas – Good Clinical Practice (GCP), las cuales son una serie de procedimientos o normas diseñadas con el fin de evitar errores y fraudes, así como para confirmar que los sujetos de una investigación clínica mantienen íntegros sus derechos dentro de la misma, justificado, bajo razones éticas, revisiones científicas, razones económicas y sus consecuencias.
El desarrollo histórico de estas prácticas viene dado con un continuo avance desde 1977, bajo el amparo de la FDA y de otras autoridades sanitarias en el mundo.
Como producto de este proceso se desarrolló la Guía ICH (International Conference on Harmonization) de GCP. Como una iniciativa conjunta de las autoridades sanitarias y de la industria farmacéutica para desarrollar discusiones técnicas y científicas sobre los requerimientos necesarios para garantizar la seguridad, calidad y eficacia de los medicamentos. Además de proveer de manera unificada a la Unión Europea, Japón y los Estados Unidos, la aceptación mutua de datos clínicos para la aprobación en cada país por parte de cada autoridad sanitaria en su jurisdicción.
Dentro de la Guía ICH de GCP se encuentra:
Un glosario, los principios de las GCP, un Consejo Institucional de Revisión, un Comité ético independiente, el investigador, o patrocinador de la investigación, el protocolo del estudio o investigación clínica con sus correspondientes enmiendas. El manual del investigador y otros documentos de importancia para la investigación como los Procedimientos Operativos Estandarizados – Standar Operating Procedure (SOP).
Sin embargo, todas las prácticas de investigación clínica requieren de una completa revisión permanente mediante un “check-list”. Para disminuir al máximo los errores que pudieran llegarse a cometer.
Igualmente, se necesita de una auditoría encargada por el patrocinador (compañía farmacéutica de investigación), pero independiente de una monitorización. Con el fin de evaluar la realización de los estudios clínicos y el cumplimiento del protocolo bajo los requisitos regulatorios pertinentes.
La investigación de los medicamentos es un tema apasionante, hoy en día Colombia tiene participación activa en la investigación clínica desde fases muy tempranas: estudios fase ll, debido a la capacidad y nivel de conocimiento de los profesionales de la salud.
De esta forma nuestro país contribuye a la búsqueda de mejores medicamentos, eficaces, seguros y con adecuadas indicaciones terapéuticas para los pacientes que los consuman.
Referencias
- 1. Juan M, et al. Departamento Internacional de Farmacovigilancia, Glaxo Group Research Laboratories Ltd. Farmacovigilancia una responsabilidad compartida. Madrid: Churchill Livingstone; 1992. p.138.
- 2. Edwars R, Aronson JK. Adverse drug reactions, definitions, diagnosis, and management. The Lancet 2000; 356:1255-59.
- 3. Emanuel E, Miller F. The Ethics of Placebo Controlled Trials. The New England Journal of Medicine 2001; 345 (12): 915-19.
- 4. Kaufman DW, Shapiro S. Epidemiological assessment of drug-induced disease. The Lancet 2000;356:1339-43.
- 5. Laporte JR. Principios Básicos de Investigación Clínica. Barcelona: Zeneca 1993. p.100.
- 6. Matos L. Farmacoepidemiología, ensayos clínicos, farmacovigilancia, estudios de utilización de medicamentos. Santiago de Compostela: Xunta de Galicia; 1995. p.266.
- 7. Page C, et al. Farmacología integrada. Madrid: Harcourt Brace Publishers International; 1998. p.380.
- 8. Quantum Research Group. Memorias Seminario/Taller Monitoreo en Investigación Clínica, GCP. Club Hato Grande, Sopó, Marzo de 2000.
- 9. Russell A, et al. Adjustments for Center in Multicenter Studies: An Overview. Annals of Internal Medicine 2001;135 (2):112-23.
CLIC AQUÍ Y DÉJANOS TU COMENTARIO