Efectos Antioxidante y Antiagregante del Fríjol Rojo
Un Probable Factor Ateroprotector en la Población Latinoamericana
Jorge H. Ulloa, MD*, Jorge Ulloa, MD**, Hasan Alam, MD, FACS***
Palabras clave: antioxidantes, antiagregantes de plaquetas, fríjol colorado, arteriosclerosis.
Resumen
La baja incidencia de enfermedad cardiovascular en Francia llevó a la realización de estudios sobre la uva roja y sus productos (jugo y vino tinto), en los cuales se encontraron flavonoides y polifenoles derivados de difenilpiranos. Los flavonoides pueden contribuir a los efectos ateroprotectores, como se ha sugerido en varios estudios que muestran asociación entre la ingesta de flavonoides con un riesgo inferior a presentar eventos coronarios con respecto a la población general, lo cual se explica por los efectos antioxidantes y antiagregantes de estas sustancias. La baja incidencia de enfermedad vascular periférica y cardiovascular en otras regiones del globo, donde el consumo de vino es más raro, sugiere la posibilidad de un factor ateroprotector en la dieta, disponible para estas poblaciones. En el área del Caribe, la región norte de Sur América y América Central, existe un alto nivel de consumo de fríjol rojo en la dieta, por lo cual éste puede ser el responsable de dicho efecto.
Diseñamos un estudio prospectivo con una población de 20 voluntarios sanos que tomaron extracto de fríjol rojo durante 14 días como suplemento a su dieta. Se registraron mediciones de agregación plaquetaria, actividad antioxidante y niveles de polifenoles.
Se demostró que el suplemento de la dieta con extracto de fríjol rojo aumenta los niveles de antioxidantes de bajo peso molecular en el suero; esto sugiere que dicho elemento puede ser el equivalente de los flavonoides de la uva roja en regiones donde su consumo es raro.
Introducción
La baja incidencia de enfermedad cardiovascular en Francia llevó al desarrollo de estudios sobre los efectos de los derivados de la uva roja, demostrándose que esta fruta tiene niveles altos de flavonoides, elementos polifenoles derivados de los difenilpiranos vegetales. Las uvas y sus derivados, especialmente aquellos hechos de la cáscara, semillas y pulpas, son una muy buena fuente de flavonoides. Estos últimos pueden contribuir al efecto ateroprotector como lo han sugerido en diferentes trabajos que muestran asociación entre su ingesta y bajos niveles poblacionales de enfermedad vascular periférica y cardiovascular (1,2). La uva roja ha mostrado, tanto in-vivo como in-vitro, importante inhibición plaquetaria y disminución de su acción trombótica en arterias coronarias caninas estenosadas. Recientemente, en estudios en humanos, los flavonoides mostraron también una disminución de la agregación plaquetaria, reversible tras la suspensión de la ingesta de productos de la uva (3,4).
La baja incidencia de enfermedad vascular periférica y cardiovascular en otras regiones del planeta donde el consumo de vino es raro, sugiere la existencia de un factor ateroprotector en la dieta de estas poblaciones. Las islas del Caribe, Centroamérica y la región norte de América del Sur, tienen un alto nivel de consumo de fríjol rojo (Phaseolus vulgaris), el cual puede ser el responsable de dicho efecto.
El fríjol rojo seco es una fuente única de nutrientes; contiene una mezcla de fibra soluble que contribuye a la buena función gastrointestinal, así como también al control de los niveles de colesterol y glicemia (5-8).
Los isoflavones del fríjol pueden tener efectos bioquímicos importantes; uno de estos bioflavones, la genisteína, es un potente inhibidor de proteincinasas, reduce la proliferación de las células cancerígenas (9,10) y tiene un efecto ateroprotector mediante una acción antioxidante que previene la lipooxidación de membranas y por lo tanto inhibe la progresión aterosclerótica en la subíntima (11-13).
Los mecanismos hipocolesterolémicos del fríjol, así como las sustancias responsables de los mismos, están todavía en etapa de investigación y discusión (14,15). Los componentes vegetales no proteicos como los isoflavones, alteran el metabolismo de las lipoproteínas mediante vías que involucran el aumento de la excreción de ácidos biliares, una probable reducción del metabolismo del colesterol, un aumento en las hormonas tiroideas o una reducción en los índices insulina/glucagón (16).
La mayoría de los componentes de las leguminosas se han estudiado en la soya. Los isoflavones de este vegetal son estructuralmente similares a los estrógenos, interactúan con los receptores estrogénicos y pueden llegar a disminuir las concentraciones séricas de colesterol por mecanismos similares ya esclarecidos. Anthony y cols. (17) reportaron que en monos alimentados con proteína de soya rica en isoflavones, se encontraban mejores valores lipídicos en suero (menores valores de colesterol y más altos niveles de colesterol-HDL) que en monos alimentados con proteína de soya pobre en isoflavones. Estudios in-vitro de cultivos de células vasculares han mostrado que el isoflavón genisteína puede inhibir el desarrollo de lesiones arterioscleróticas mediante una disminución en la adhesión celular, una alteración de la actividad de factores de crecimiento y finalmente una inhibición de la proliferación celular (18).
La formación de trombina y la activación plaquetaria son inhibidas también por derivados de leguminosas (como la genisteína) in-vivo. Sin embargo los estudios clínicos en humanos, han fallado en mostrar un efecto significativo de las dietas ricas en isoflavones de proteína de soya (19).
Debido a que la oxidación de LDL desempeña un rol principal en la patogénesis de la arteriosclerosis, los isoflavones de las leguminosas, particularmente del fríjol rojo, pueden llegar a tener un efecto contra ésta en los humanos (20,21). La oxidación de LDL dispara una cascada de eventos que incluye agregación plaquetaria acelerada, daño al endotelio arterial (22) y producción de citocinas, factores de adhesión, factores de crecimiento y otras moléculas que facilitan el desarrollo de la placa arteriosclerótica. Estudios in-vivo sugieren que la genisteína y la daidzeína inhiben la oxidación de LDL en el subendotelio de una manera similar a como lo hace la vitamina E (23).
Con base en la hipótesis de que una dieta suplementada con cantidades importantes de fríjol rojo puede ejercer un efecto ateroprotector similar al observado por otros grupos en Europa mediterránea, diseñamos un estudio donde se estudiaron los efectos de una dieta suplementada con extracto de este tipo de fríjol.
Materiales y Métodos
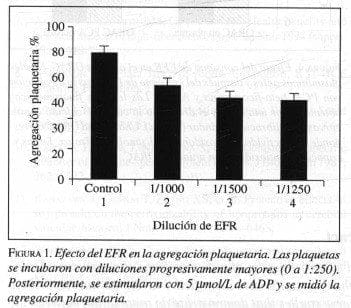
Se obtuvo sangre venosa de individuos sanos que no recibieron suplementos vitamínicos o inhibidores plaquetarios durante un período mayor a siete días previos al reclutamiento en el estudio. Esta sangre fue incubada con extracto de fríjol rojo (Cargamanto beans, Rionegro, Colombia) por un período de 20 minutos a temperatura ambiente (24). El aislamiento plaquetario y la agregación de las mismas se realizó según las pautas descritas por Freedman y cols. (25) con un agregómetro de impedancia (Chronolog Corp, Havertown, PA).
Para estudiar los efectos de la suplementación dietética con EFR, 20 individuos sanos (edad media 24,7±1,4 años, rango 20 a 43 años, catorce hombres, seis mujeres) consumieron EFR tras haber obtenido consentimiento informado en nuestro centro. Cada donante consumió 3ml/kg/día de EFR durante catorce días. La dosificación fue controlada en nuestra consulta diariamente. A lo largo del estudio, los voluntarios no consumieron medicamentos, cafeína, alcohol, suplementos vitamínicos, ajo o hierba alguna.
Análisis de antioxidantes
Los niveles séricos de a-tocoferol y g-tocoferol fueron determinados mediante cromatografía líquida de alto rendimiento (HPLC) con detección electroquímica (26). Se realizaron estudios de absorbancia de radicales de oxígeno en plasma (ORAC) y de actividad antioxidante independiente de proteínas en fase plasma-fenoclórica (PCA). Doscientos microlitros de beta-ficoeritrina en PBS (concentración final 16,7 pmol/L) fueron agregados a 30 mL de la muestra, seguidos de adición de 70 mL de dihidrocloruro 2,2′-azobis-(2-amidinopropano) (AAPH) en PBS (4 mmol/L concentración final). Se usó Trolox (6-Hidroxi-2,5,7,8-tetrametilcroman-2-ácido carboxílico) en PBS o en PBS con cantidades correspondientes de PCA) como antioxidante de referencia para calibración (27). Los kits Sigma cholesterol‚ (procedimiento 352) y HDL cholesterol‚ (procedimiento 352-3) se utilizaron para las mediciones de colesterol en plasma total, HDL y LDL-colesterol.
Análisis de polifenoles
El grupo de componentes polifenólicos se separó mediante HPLC en columna de fase reversa (C18, partículas de 10 mmol/L, 4,5 mmx25 cm de diámetro interno por longitud) en cinco subgrupos. La identificación cualitativa de estos componentes se llevó a cabo mediante detección y análisis del espectro visible/UV de los picos más altos en cada fracción (Millennium chromatography software‚ (Waters Corporation,
Milford, MA).
Los componentes fenólicos se agruparon en cuatro clases: ácidos ciamídicos (ésteres de ácido ferúlico y cumárico) y tres tipos de flavonoides: antocianinos (cianidina y glucósidos de delfinidina), flavonoles (glucósidos de quercetina) y poliflavan-3-oles (conocidos también como taninos condensados) (28).
Análisis estadístico
Los datos fueron presentados como media ± desviación estándar. Las muestras pareadas se compararon con la prueba t de Student. Las curvas de dosis-respuesta fueron evaluadas utilizando la prueba comparativa de Dunnett. Se aceptó una P<0.05.
Resultados
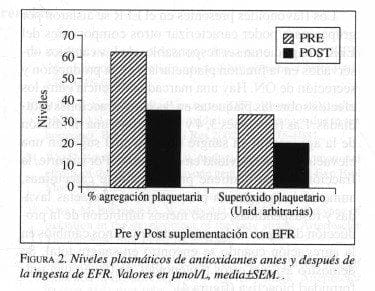
Para determinar si la suplementación dietética con EFR en individuos sanos alteraba o no el contenido de antioxidantes plasmáticos, se determinaron niveles de a y g-tocoferol antes y después del consumo de EFR. No hubo cambios significativos en los niveles de a-tocoferol; sin embargo, los niveles de b-tocoferol tuvieron un aumento modesto tras catorce días de consumo de EFR (de 13,5±0,4 a 15,2±0,5 mmol/L (P=0,008)). (g-tocoferol, de 2,4±0,2 a 3,9±0,8 mmol/L (P=0,07)).
El efecto del EFR en la actividad antioxidante se determinó mediante cuantificación de capacidad de absorbencia de radicales de oxígeno en plasma con el estudio ORAC. Dicha actividad se elevó de 0,5±0,2 a 0,7±0,3 unidades ORACx1000 (según medidas de niveles ORAC de proteína libre en plasma). Las medidas ORAC totales en plasma no cambiaron significativamente (de 5,1±0,4 a 5,8±0,3, P=NS;), lo cual sugiere que la ingestión de EFR aumenta los antioxidantes de bajo peso molecular en plasma. No hubo cambios significativos en los niveles de colesterol plasmático tras los aportes con EFR.
Discusión
En este estudio se determinaron los efectos in-vitro y ex-vivo, así como las fracciones obtenidas de flavonoides en la función plaquetaria tras la suplementación dietética con EFR. El consumo de este elemento por parte de voluntarios sanos y la incubación plaquetaria secundaria llevó a una inhibición dosis-dependiente de la agregación plaquetaria en un proceso que puede involucrar la producción de óxido nítrico (ON). El superóxido es un subproducto plaquetario (29) y según nuestros hallazgos, su liberación se vio comprometida al entrar en contacto con el EFR.
La bioactividad del ON es dependiente del estatus antioxidante. Los flavonoides tienen capacidad antioxidante y pueden llegar a afectar los fenómenos trombóticos mediante cambios en otros antioxidantes.
El consumo de EFR aumentó significativamente los niveles de a-tocoferol y en forma no significativa los de g-tocoferol. Las procianidinas aisladas en el EFR disminuyen la peroxidación de las membranas y previenen la pérdida de vitamina E. El incremento en a-tocoferol es muy interesante, debido a que este elemento es un antioxidante claramente dirigido a las plaquetas con conocidos efectos antitrombóticos (30) (figura 1).
Sin embargo, los cambios en los niveles de a-tocoferol fueron relativamente bajos y abren la posibilidad de que exista otro elemento en el EFR causante de los efectos inhibitorios encontrados en las plaquetas (figura 2). La capacidad antioxidante en plasma fue significativamente elevada tras el consumo de EFR, según lo demostró el análisis ORAC. Los experimentos en proteína total y libres de proteína mostraron que después del consumo de EFR hubo un incremento de los antioxidantes en fase acuosa, mas no en la reserva liposoluble. Este experimento es altamente sensible, aunque refleja numerosos antioxidantes y no determina cuál es el responsable de los cambios.
Mediante la utilización de agonistas dependientes de proteincinasa (PMA) se detectaron cambios en la función plaquetaria. Adicionalmente, la incubación de plaquetas con EFR mostró una inhibición de la actividad de la proteincinasa. Los radicales libres pueden causar una activación a través de la regulación de estas cinasas; por lo tanto, el metabolismo antioxidante tanto de los radicales libres de oxígeno exógenos como propios de la plaqueta activarían las proteincinasas y potencialmente la producción de ON. Algunos flavonoides, incluida la quercitina, han mostrado previamente la inhibición de las proteincinasas mediante este mecanismo (31) (figura 3).
Los flavonoides presentes en el EFR se aislaron por grupos para poder caracterizar otros componentes del EFR que pudieran ser responsables de los cambios observados en la función plaquetaria y en la producción y secreción de ON. Hay una marcada diferencia entre los efectos sobre las plaquetas en las cinco fracciones estudiadas. Las fracciones 3, 4 y 5 llevaron a una inhibición de la agregación en sangre total, lo cual sugieren una elevación de su actividad en este medio. Por su parte, la fracción 2, que contiene principalmente catecininas, aumentó la agregación plaquetaria en plaquetas lavadas y resuspendidas, causó menos inhibición de la producción de superóxido, generando mínimos cambios en la agregación cuando se encontró en sangre total. Se demostró así que estos flavonoides no tienen una uniformidad bioactiva (figura 4).
En resumen, tanto la incubación in-vitro, como la suplementación oral con EFR, disminuyeron la agregación plaquetaria y la producción de superóxido. La suplementación oral tuvo un discreto pero significativo efecto en los niveles antioxidantes, que no puede ser enteramente adjudicable a la antiagregación plaquetaria observada.
A pesar que los flavonoides son presumiblemente el componente activo del EFR, los subgrupos extraídos de este compuesto tienen diversos efectos en las plaquetas; por lo tanto, la inhibición de la función plaquetaria y de la producción de superóxido puede ser resultante del efecto de flavonoides encontrados en el EFR. La supresión de la trombosis, mediada por plaquetas, representa posible uso para los efectos benéficos del fríjol rojo en la enfermedad vascular periférica y cardiovascular.
Abstract
The low incidence of cardiovascular disease in France led to investigation of red grapes and their products (juice and red wine); flavonoids and polyphenols derived from diphenylpyranes were identified. Flavonoids may contribute to atheroprotector effects, as suggested by the results of diverse studies that demonstrate an association between the intake of flavonoids and a diminished risk of coronary events in comparison to the general population, a phenomenon that could be explained by the antioxidant and antiaggregant effects of these substances. The low incidence of peripheral vascular and cardiovascular disease in other parts of the world where wine consumption is scarce, suggests the possibility of an atheroprotector factor in the usual diets of these populations. In the Caribbean area, in the northern region of South America and Central America there is a high dietary intake of red beans, and this could be the responsible factor.
We designed a prospective study in a population of 20 healthy volunteers that ingested a red bean extract for 14 days as supplement of their diet, with determinations of platelet aggregation, antioxidant activity, and polyphenol levels.
Results show that the dietary supplement of red bean extract increases the serum levels of low molecular weight antioxidants. This finding suggests that this element may be the equivalent to the flavonoids of red grapes in region where it is not consumed.
Key words: antioxidants, platelet aggregation inhibitors, beans, arteriosclerosis.
Referencias
1. Rimm E, Katan M, Ascherio A, et al. Relation between intake of flavonoids and risk for coronary heart disease in male health professionals. Ann Intern Med 1996; 125: 384-389.
2. Knekt P, Jarvinen R, Reunanen A, et al. Flavonoid intake and coronary mortality in Finland: a cohort study. BMJ 1996; 312: 478-481.
3. Keevil JG, Osman HE, Reed JD, et al. Grape juice, but not orange juice or grapefruit juice, inhibits human platelet aggregation. J Nutr 2000; 130: 53-56.
4. Demrow H, Slane P, Folts J. Administration of wine and grape juice inhibits in-vivo platelet activity and thrombosis in stenosed canine coronary arteries Circulation 1995; 91: 1182-1188.
5. Parra S, Fernández MC, Vandale T, López L. Dietary fiber and gastro-intestinal cancer, implication for the mexican population. Arch Latinoam Nutr 1994; 44: 76-81
6. Bhatty N, Gilani A, Ahmad N et al. Nutritional value of mung bean (vigna radiata) as effected by cooking and supplementation. Arch Latinoam Nutr 2000; 50: 374-379.
7. Anderson JW, Smith BM, Gustafson NJ. Health benefits and practical aspects of high-fiber diets. Am J Clin Nutr 1994 (suppl); 59: 1242S-7S.
8. Anderson JW. Plant fiber in foods. Lexington, KY: HCF Nutrition Foundation, 1990.
9. Lévano J. Phytochemical investigation in beans. Rev Serv Sanid Fuerzas Polic 1990; 51: 45-47.
10. Akiyama T, Ishida J, Nakagawa S, et al. Genistein, a specific inhibitor of tyrosine-specific protein kinases. J Biol Chem 1987; 262: 5592-5595.
11. Kanazawa T, Osanai T, Zhang XS, et al. Protective effects of soy protein on the peroxidizability of lipoproteins in cerebral vascular diseases. J Nutr 1995; 125: 639S-646S.
12. Wei H, Bowen R, Cai Q, et al. Antioxidant and antipromotional effects of the soybean isoflavone genistein. Proc Soc Exp Biol Med 1995; 208: 124-30.
13 Peterson G. Evaluation of the biochemical targets of genistein in tumor cells. J Nutr 1995; 125: 784S-789S.
14 Lovati MR, Manzoni C, Corsini A, et al. 7S globulin from soybean is metabolized in human cell cultures by a specific uptake and degradation system. J Nutr 1996; 126: 2831-2842.
15 Anthony MS, Clarkson TB, Hughes CL Jr, et al. Soy isoflavones improve cardiovascular risk factors without affecting the reproductive system of peripubertal rhesus monkeys. J Nutr 1996; 126: 43-50
16. Potter S. Overview of proposed mechanism for the hypocholesterolemic effect of soy. J Nutr 1996; 125: 606S-611S.
17 1997 Cardiovascular Statistics. Dallas: American Heart Association, 1996.
18. Fotsis T, Pepper M, Adlercreutz H, et al, a dietary ingested isoflavonoid, inhibits cell proliferation and in-vitro angiogenesis. J Nutr 1995; 125: 790S-797S.
19 Wilcox JN, Blumenthal BF. Thrombotic mechanisms in atherosclerosis: potential impact of soy proteins. J Nutr 1995; 125: 631S-638S.
20 Barp J, Araújo ASR, Fernández TRG, Rigatto KV, et al. Myocardial antioxidant and oxidative stress changes due to sex hormones. Braz. J Med Biol Res 2002; 35: 1075-1081.
21 Wei H, Bowen R, Cai Q, et al. Antioxidant and antipromotional effects of the soybean isoflavone genistein. Proc Soc Exp Biol Med 1995; 208: 124-130.
22 Navab M, Berliner JA, Watson AD, et al. The yin and yang of oxidation in the development of the fatty streak. Arterioscler Thromb Vasc Biol 1996; 16: 831-842.
23 Navab M, Berliner JA, Watson AD, et al. The yin and yang of oxidation in the development of the fatty streak. Arterioscler Thromb Vasc Biol 1996; 16: 831-842.
24 Hernández P, González M, Rodríguez de Pablos V, Ganen Báez, FA. Study of phytohemagglutinin from red bean (Phaseolus vulgaris). Rev Cuba Hematol Inmunol Hemoter 1999; 15: 210-214.
25 Freedman JE, Farhat J, Loscalzo J, et al. [alpha]-Tocopherol inhibits aggregation of human platelets by a protein kinase C-dependent mechanism. Circulation 1996; 94: 2434-2440.
26 Stocker R, Bowry V, Frei B. Ubiquinol-10 protects human low density lipoprotein more efficiently against lipid peroxidation than does alpha-tocopherol. Proc Natl Acad Sci USA. 1991; 88: 1646-1650.
27 Cao G, Alessio H, Cutler R. Oxygen-radical absorbance capacity assay for antioxidants. Free Radic Biol Med 1993; 14: 303-311.
28 Freedman JE, Parker C, Li LMS, Perlman JA, et al. Select flavonoids and whole juice from purple grapes inhibit platelet function and enhance nitric oxide release. Circulation 2001; 103: 2792-2798.
29 Freedman J, Keaney J. NO and superoxide in human platelets. In: Packer L, ed. Nitric Oxide, Part C: Biological and Antioxidant Activities. San Diego, Calif Academic Press; 1999; 61-67.
30 Freedman J, Keaney J. NO and superoxide in human platelets. In: Packer L, ed. Nitric Oxide, Part C: Biological and Antioxidant Activities. San Diego, Calif: Academic Press; 1999; 61-67.
31 Kooy M, Akkerman W, Van Asbeck S, et al. UVB radiation exposes fibrinogen binding sites on platelets by activating protein kinase C via reactive oxygen species. Br J Haematol 1992; 83: 253-258.
Correspondencia:
Jorge H. Ulloa
Uniformed Services University of the Health Sciences
4301 Jones Bridge Road Department of Surgery
Bethesda, MD 20814, Tel.: (301) 295-9839
Correo electrónico: cirugiavascular@yahoo.com
CLIC AQUÍ Y DÉJANOS TU COMENTARIO