Alteraciones Otorrinolaringológicas en pacientes con Fibrosis Quística, Diseño Experimental
A todos los pacientes referidos a la clínica de fibrosis quística del Instituto Nacional de Enfermedades Respiratorias, se les realizó un cuestionario desde el punto de vista otorrinolaringológico (sintomatología crónica, obstructiva, cefalea, obstrucción nasal, rinorrea mucopurulenta, tos crónica, prurito nasal, algia facial, alteraciones olfatorias, voz mormada, fiebre, congestión nasal, otorrea, pólipos nasales); con una exploración física completa (rinoscopia anterior y posterior); realizando una endoscopia en el consultorio a aquellos pacientes en los que se encontró indicada, preparando al paciente con un vasoconstrictor.
El estudio se llevó a cabo sin la menor molestia para el paciente utilizando endoscopios de 0º, 4 mm y de 30º, 2.7 mm Hopkins, primero en dirección anteroposterior sobre el piso de la nariz hasta la nasofaringe (visualizando trompa de Eustaquio); posteriormente se retiró en dirección posteroanterior para visualizar cornete y meato inferior; después se visualizó el meato medio en busca de la permeabilidad del complejo osteomeatal (sitio drenaje común de los senos etmoidales anteriores, seno maxilar y frontal), y de alteraciones que puedan en un momento determinado comprometer la permeabilidad del mismo (pólipos, secreción espesa amarillo-verdosa), así mismo se observó cornete y meato superior.
Se realizó una exploración otológica completa ayudados por el microscopio Zeiss con lente de 300 x visualizando el CAE, la integridad de la membrana timpánica, cadena osicular y auxiliándonos de una lámpara frontal se visualizó la cavidad oral examinando amígdalas palatinas, descarga posterior orofaríngea y descartando cualquier otra patología que se hubiera podido presentar al examen físico.
Los pacientes que así lo requirieron:
(En los que encontramos evidencia de patología clínica) y en que su estado general no contraindica la realización de estudios se les realizó Tomografía Computarizada de nariz y senos paranasales en cortes axilares y coronales, esto con la finalidad de observar el estado de la mucosa y de las cavidades que conforman los senos paranasales en su interior.
En caso de evidenciar patología nasosinusal (poliposis o enfermedad inflamatoria crónica nasosinusal) se realizó una cirugía endoscópica para resección de pólipos (en su caso) y etmoidectomía anterior con la creación de una ventana nasoantral en meato medio, cirugía endoscópica funcional según técnica de Stammberger (22, 23); con la colocación de sondas de alimentación nasogástrica del número 6 (pediátricas) en el piso del seno maxilar para la irrigación postoperatoria con tobramicina (cirugía endoscópica con lavado seriado antimicrobiano o CELAS).
Los lavados con antimicrobiano consistieron en la instilación a través de las sondas de 40 mg de tobramicina (1 mL) diluida en 5 cc de agua destilada tres veces al día durante 10 días (los niveles séricos de tobramicina se calculan en 2 ng/mL. Después de 30 a 60 minutos de la instilación (11, 24, 25), al término de los cuales se retiraron las sondas y quedaron abiertas las cavidades para su valoración posterior.
El seguimiento de los pacientes se realizó desde el punto de vista sintomático (subjetivo) y las valoraciones postoperatorias del estado de la mucosa nasosinusal (objetivo) con la ayuda del microscopio así como de los endoscopios rígidos y flexible en la primera y tercera semana, uno, dos, seis, doce, dieciocho y veinticuatro meses respectivamente.
Resultados
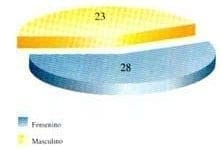
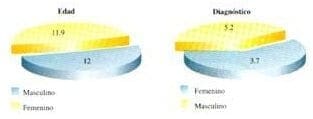
Estudiamos 51 pacientes por parte de la clínica de fibrosis quística; 23 hombres y 28 mujeres (Gráfica 1); el rango de edad para los pacientes del sexo masculino fue de 7 meses a 28 años con promedio de 12.08 años y para los pacientes de sexo femenino fue de 11 meses a 44 años, con promedio de edad de 11.96 años. El promedio de edad para el diagnóstico de fibrosis quística en los hombres fue de 3.7 años y para las mujeres fue de 5.21 años (Gráfica 2).
 Gráfica 1. Distribución por sexo.
Gráfica 1. Distribución por sexo.
 Gráfica 2. Edad diagnóstica de fibrosis quística.
Gráfica 2. Edad diagnóstica de fibrosis quística.
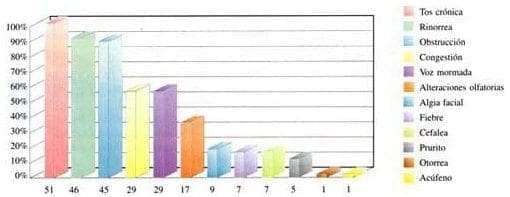
Los síntomas otorrinolaringológicos más frecuentes fueron:
- Tos crónica en 51 pacientes (100%)
- Rinorrea anterior mucopurulenta 46 pacientes (90%)
- Obstrucción nasal 45 pacientes (88%)
- Congestión nasal 29 pacientes (56%)
- Voz mormada 29 pacientes (56%)
- Alteraciones olfatorias en 17 pacientes (33%)
- Algia facial en 9 pacientes (17.5%)
- Fiebre en 7 pacientes (13.5%)
- Cefalea en 7 pacientes (13.5%)
- Prurito nasal 5 pacientes (9.8%)
- Otorrea 1 paciente (1.9%)
- Acúfeno en 1 paciente (1.9%) (Gráfica 3).
 Número de pacientes
Número de pacientes
Gráfica 3. Síntomas otorrinolaringológicos en pacientes con fibrosis quística.
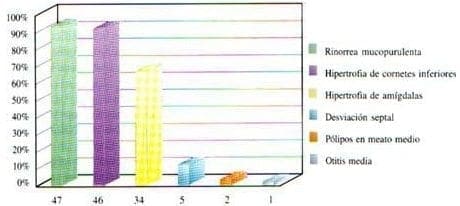
Los signos otorrinolaringológicos más frecuentes son:
- Cuarenta y siete pacientes con rinorrea mucopurulenta posterior (92%)
- Hipertrofia de cornetes inferiores (90%)
- Amígdalas palatinas GI 34 pacientes (66%)
- GII 12 pacientes (3.5%)
- GIII 4 pacientes (7.8%)
- Desviación septal 5 pacientes (9.8%)
- Pólipos en meato medio 2 pacientes (3.9%)
- Otitis media serosa 1 paciente (1.9%). (Gráfica 4).
 Número de pacientes
Número de pacientes
Gráfica 4. Signos en pacientes con fibrosis quítica.
Desde el punto de vista radiológico se estudiaron 31 pacientes a los cuales se les realizó Tomografía Computarizada de nariz y de senos paranasales en cortes axiales y coronales.
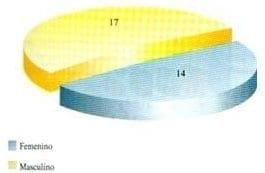
Diecisiete pacientes de sexo masculino y 14 pacientes de sexo femenino, con un promedio de edad para los de sexo masculino de 9.8 años y para los de sexo femenino de 18.2 años (Gráfica 5).
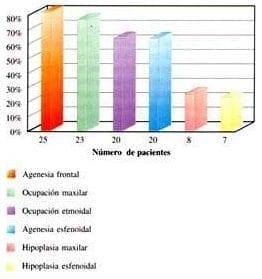
Encontrando en los senos frontales 25 pacientes con agenesia (80%); un paciente presentó ocupación del seno frontal (3.2%); cinco pacientes no presentaron anomalías en senos frontales (16%); en los senos etmoidales 20 pacientes (64.5%) presentaban ocupación en las celdillas etmoidales anteriores y posteriores, siete pacientes (22.5%) presentaron ocupación en las celdillas etmoidales anteriores solamente y cuatro pacientes (12.9%) no presentaban alteración.
 Gráfica 5. Tomografía computarizada realizada por sexo.
Gráfica 5. Tomografía computarizada realizada por sexo.
En los senos maxilares 23 pacientes (75%) tenían ocupados los senos bilateralmente; ocho pacientes presentaban hipoplasia (25%) (tipo I un paciente 3.2%), tipo II cinco pacientes (16%), tipo III dos pacientes (6.4%). En los senos esfenoidales se encontraron 20 pacientes con agenesia (64.5%); hipoplasia en siete pacientes (22.5%) ocupados en dos pacientes (6.4%), normal dos pacientes (6.4%) (Gráfica 6).
 Gráfica 6. Hallazgos en senos paranasales con fibrosis quística.
Gráfica 6. Hallazgos en senos paranasales con fibrosis quística.
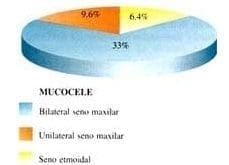
Se encontraron imágenes que surgieron la formación de mucoceles “pseudomucocele” en los senos maxilares (medialización de la pared lateral nasal con adelgazamiento de la misma) 17 pacientes presentaban mucocele maxilar bilateral (33%); tres pacientes presentaron pseudomucocele unilateral (9.6%), de los cuales dos fueron derechos y uno en el seno maxilar izquierdo, así mismo dos pacientes (6.4%) presentaron mucocele etmoidal (Gráfica 7).
 Gráfica 7. Localización del Mucocele.
Gráfica 7. Localización del Mucocele.
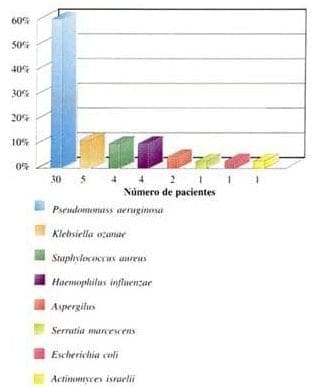
A todos los pacientes se les tomó cultivo de los cuales 30 pacientes presentaban Pseudomonas aeruginosa (58.8%); cinco pacientes con Klebsiella ozanae (9.8%); cuatro pacientes Staphylococcus aureus(7.8%); cuatro pacientes Haemophilus influenzae (7.8%); dos con Aspergilus Niger (3.9%); uno con Serratia marcescens (1.9%); un paciente con Escherichia coli (1.9%) y un paciente con Actinomices israelii(1.9%) (Gráfica 8).
 Gráfica 8. Resultados de cultivo.
Gráfica 8. Resultados de cultivo.
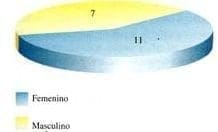
Se realizaron 18 cirugías endoscópicas con lavado seriado antimicrobiano (CELAS), 11 pacientes de sexo femenino (61%) y siete de sexo masculino (39%); también se efectuaron dos procedimientos de amigdalectomía (11%); tres procedimientos de septoplastia (17%) y a un paciente se le realizó esfenoidectomía (5.5%) (Gráfica 9).
 Gráfica 9. Distribución por sexo en pacientes sometidos a C.E.L.A.S.
Gráfica 9. Distribución por sexo en pacientes sometidos a C.E.L.A.S.
Posterior al procedimiento quirúrgico se les realizó seguimiento a todos los pacientes (100%) a la semana, dos semanas, un mes, tres, seis, dieciocho y veinticuatro meses respectivamente, encontrando una mejoría significativa desde el punto de vista clínico (subjetivo) en cuanto a su sintomatología, refiriendo mejoría en su sintomatología nasosinusal previa.
Discusión
La fibrosis quística es una alteración genética que se hereda con un patrón autosómico recesivo. El gen responsable de la fibrosis quística fue identificado usando la técnica genética llamada de posición.
El producto genético es llamado regulador de la conductancia transmembrana de la fibrosis quística llamado así porque juega un papel en el transporte electrolítico de los tejidos epiteliales, es un largo gen compuesto de 27 uniones abarcando aproximadamente 250 Kb de ADN y codificando ARN mensajero de 6.5 Kb (27).
El ARN de la conductancia transmembrana de la fibrosis quística se manifiesta clásicamente en los tejidos epiteliales en infección de diversos sistemas como la vía aérea superior e inferior, en páncreas, glándulas sudoríparas, hígado, intestino, testículo entre otros. Los estudios de ARN indican un bajo nivel en la transcripción de la conductancia transmembrana de la fibrosis quística, (aproximadamente uno por célula) en el epitelio respiratorio, pero con niveles más altos en páncreas e intestino (28).
El bajo nivel de la expresión de la conductancia transmembrana de la fibrosis quística en el pulmón ha dificultado el estudio de la proteína, pero así mismo puede ser detectado en el páncreas, riñón e intestino y principalmente en el ámbito de la mucosa nasal (midiendo el potencial eléctrico transmembrana y el genotipo), con la identificación de la conductancia transmembrana de la fibrosis quística y proporcionando una idea posible en la estructura de la proteína producida.
La secuencia de aminoácidos tiene 2 campos hidrófilos (tm1 y TM2) dos regiones de ATP (nbd1 y NBD2) y campos reguladores que contienen múltiples sitios para la fosforalización de proteínas; todas estas estructuras son similares a una larga familia de proteínas que transportan moléculas (azúcar, aminoácidos) dentro o fuera de las células y dependiente de ATP.
La conductancia transmembrana de la fibrosis quística:
Tiene la capacidad de regular la activación de los canales de cloro en las células epiteliales (30); la mutación causa la omisión de un aminoácido (fenil-alanina) y ha sido llamado d-F 508; ésta mutación se presenta en el 80% de la población caucásica, es la más frecuente de la población y la más estudiada, pero se han encontrado más de 500 mutaciones (31) y se caracterizan por una lateración en el transporte del cloro y sodio (18) para el regulador de la conductancia transmembrana (12, 32, 33).
Lo que origina una disfunción hidroelectrolítica en la superficie apical de las células ciliadas caracterizada por una falta de excreción de cloro y una hiperabsorción de sodio y agua desde la luz del epitelio ciliado, lo cual trae como consecuencia una deshidratación del moco, el cual se vuelve más espeso y pegajoso (1-11).
Obstruyendo los orificios de ventilación y drenaje sinusales causando hipoxia y retención de bióxido de carbono, dando como resultado una lesión ciliar, edema de mucosas, inflamación lo que predispone a la colonización de bacterias e infección principalmente por gérmenes como es el Staphylococcus aureus, Haemophilus influenzae y principalmente Pseudomonas aeruginosa (34) (Figura 4).
 Figura 4. Colonización bacteriana.
Figura 4. Colonización bacteriana.
La adherencia al epitelio respiratorio de moco ha sido considerada el primer paso para el establecimiento de la infección sinubronquial por Pseudomonas; los mecanismos de la adherencia específicos para esta bacteria son complejos.
Las células epiteliales de los individuos normales son relativamente resistentes a la Pseudomonas y por tanto hay sugerencias que evidencian las células epiteliales respiratorias en los pacientes con fibrosis quística los cuales son más susceptibles incrementando la adherencia de cepas no mucoides de Pseudomonas en las células epiteliales bucales de los pacientes con fibrosis quística comparados con los pacientes normales (35).
El incremento de la adherencia se correlaciona con la disminución de la cantidad de fibronectina en la superficie celular e incremento de los niveles de las proteasas de la saliva; se presenta una alteración de los gliconjugados que es la clave de los receptores de la superficie del epitelio celular, particularmente los residuos terminales de ácido siálico; éste defecto en la acidificación y en los organelos terminales conducen a una disminución de los gliconjugados en las células de los pacientes con fibrosis quística y que pueden predisponer a la adherencia de Pseudomonas aeruginosa; además ésta produce hialunonidasas que tienen la capacidad de alterar los gliconjugados facilitando la adherencia al epitelio (36).
La adaptación de la Pseudomonas en el medio ambiente del huésped y la alteración de las defensas locales del mismo producen la infección sinubronquial crónica, con obstrucción del mecanismo de limpieza mucociliar obligando al tratamiento médico-quirúrgico (17).
En nuestro estudio:
Los pacientes presentaron predominantemente afección en los senos paranasales etmoidales y maxilares caracterizados clínicamente por tos crónica, obstrucción nasal, congestión y rinorrea mucopurulenta, así mismo encontramos datos que sugirieron enfermedad inflamatoria nasosinusal en rinorrea posterior mucopurulenta, hipertrofia de cornetes inferiores, medialización de la pared lateral nasal y en algunos pacientes poliposis nasal; todos estos datos clínicos que sugirieron enfermedad nasosinusal fueron corroborados tomográficamente por opacificaciones predominantemente etmoidomaxilares bilaterales.
Un dato muy característico fue la medialización y adelgazamiento de la pared lateral nasal, dato que anteriormente ya había sido reportado (21), otro dato relevante fue que solo 3.9% de los pacientes presentó poliposis en comparación con otros estudios que reportaban de 6 a 48% (15).
Todos los pacientes a los cuales se les realizó cirugía endoscópica con lavado seriado antimicrobiano (celas) (11), presentaron tanto clínica como radiológicamente datos de patología nasosinusal, cabe decir que la normalización del estado de la mucosa no es posible en estos pacientes debido a la alteración primaria de la misma y por esta razón varios investigadores (37) indican que la decisión quirúrgica en estos pacientes es difícil ya que todos presentan alteraciones radiológicas, independientemente de su sintomatología nasosinusal (38-40).
Asi mismo existe una discrepancia entre la sintomatología del paciente (por lo general es mínima) y los hallazgos tomográficos, (por lo general es muy marcada), lo cual nos lleva al dilema de si operar o no; puede que exista una adaptación del paciente a su enfermedad y que clínicamente no lo demuestre (38-41), además el proceso de la enfermedad en los pacientes con fibrosis quística permanece inalterable a pesar del tratamiento médico quirúrgico (42).
Basados en varios estudios (37, 38, 43) se apoya la cirugía endoscópica funcional con lavado antimicrobiano en pacientes con fibrosis quística cuando:
- Persiste obstrucción nasal asociada con poliposis nasal o medialización de la pared nasal después de un tratamiento médico intensivo, particularmente con pérdida de olfato ronquido y respiración oral.
- Medialización de la pared lateral nasal (endoscópica y tomográficamente con obstrucción de la vía aérea con una probabilidad de formación de pseudomucocele.
- Exacerbaciones pulmonares que aparecen y se corroboran con exacerbaciones de enfermedad nasosinusal (particularmente con presencia de rinorrea mucopurulenta).
- Algia facial, cefalea que no tiene otra causa aparente y que afecta la calidad de vida.
- Mejora la calidad de vida en pacientes con síntomas.
Todo este procedimiento quirúrgico que empleamos (CELAS) tiene como finalidad remover los pólipos, las secreciones, mejorar la ventilación y el drenaje de los senos paranasales al realizar la etmoidectomía anterior y al hacer una ventana nasoantral en meato medio preservando las estructuras anatómicas normales y con el menor daño anatómico posible. Además la colocación de las sondas hacia el piso de los senos maxilares provee un acceso fácil para la instilación de antibiótico (tobramicina) que el mismo paciente puede llevar a cabo en su domicilio.
Con esto buscamos disminuir la colonización bacteriana porPseudomonas en el interior de los senos paranasales y facilitar el acceso a los mismos en el seguimiento del paciente.
A dos años de seguimiento a los pacientes han mejorado notablemente su sintomatología nasosinusal y broncopulmonar (disminución en la tos crónica), así como una disminución en el cuadro de hospitalizaciones secundario a enfermedad pulmonar (44); lo cual nos hace pensar que el eliminar un foco infeccioso importante de la vía respiratoria superior mejora la calidad de vida del paciente con fibrosis quística.
El seguimiento postquirúrgico consistió en la revisión periódica de las cavidades con utilización del endoscopio rígido o flexible a corto, mediano y largo plazo con la finalidad de detectar activación de la patología en la mucosa de manera temprana para así establecer un tratamiento médico oportuno, incluso antes de que el paciente pudiera referir sintomatología.
Conclusiones
- Todos los pacientes con fibrosis quística presentan alteraciones anatómicas, funcionales y radiológicas en los senos paranasales.
- Ninguna otra alteración otorrinolaringológica que no fuese relacionada con la nariz y los senos paranasales fue evidente en nuestro estudio.
- La cirugía endoscópica con lavado seriado antimicrobiano mejora notablemente la sintomatología nasosinusal en pacientes con fibrosis quística.
- Lo único que puede justificar el procedimiento quirúrgico es la mejoría subjetiva clínica del paciente.
- No se realizó el procedimiento quirúrgico como tratamiento definitivo, sino como un tratamiento coadyudante, enfatizando el cuidado multidisciplinario de los pacientes.
Correspondencia: Fabio Blanco Leguizamón Santafé de Bogotá, Colombia.
Bibliografía
- 1. Welsh MJ, Smith AE. Cystic Fibrosis. Scientific American. 1995; 273:36-43.
- 2. Encycl Med, chir (Paris – France). Pediatría. 1988. EMC 1-12. 4060 p.
- 3. Gibson L, Cooke R. H test for concentration of electrolytes in sweat in CF utilizing pilocarpine by iontophoresis. Pediatrics. 1959; 23:545-549.
- 4. Alfred P. Fischman. Update: pulmonary diseases and disorders. Section III, Charper 6, 1992.
- 5. Rommans JM, Iannuzzi MC, Kerem BS, et al. Identification in the CF gene chrosome walking jumping, Science. 1989; 245: 1059-1065.
- 6. Hilman BC. Lewisston NJ. Pediatric Respiratory disease, chapter 1995; 70: 573-661.
- 7. Collins FS. The CF Gene; perceptions, puzzles and promises. Pediatric Pulmonol. 1992; suppl 8:63-64.
- 8. Lurie MH. CF on the pancreas and the mucosa nasal. ANN Otorhinolaryngol. 1959; 68:478.
- 9. Schwachman H, Kunychi Y, Mueller H Flake. Nasal polyps in patients with CF. Pediatrics 1962; 30:389-401.
- 10. Thaler ER, Smuller SM, Kennedy DW. Adult Cystic fibrosis presenting with nasal polyps and chronic sinusitis. Am. J. Rhinology. 1994.
- 11. Moss B, Richard, King Victoria V. Management of sinusitis in cystic fibrosis by endoscopic surgery and serial antimicrobial lavage. Arch. Otolaryngol Head Neck Surg. 1995;121:566-572.
- 12. Parsons DS. Sinusitis and Cystic Fibrosis: pediatric sinusitis, de R.P. Lisk Reven press New York. 1992; pp 65-70.
- 13. Highsmith W.E. Burch LH, Zhow Z, et al. A novel mulation in the cystic fibrosis gene in patient with pulmonary disease but normal sweat chloride concentrtion. N. Eng J.M, oct 1994; pp 974-980.
- 14. Stewart B, Zabner J. Shuber AP, et al. Normal sweat chloide values do not excluye the diagnosis of cystic fibrosis. Am J. Respir Crit. Care Med. 1995; 151: 899-903.
- 15. Lusk RP. Pediatric sinusitis. Chapter 1992;8:65-70.
Referencias
- 16. White LG. Pediatric respiratory disease chapter. 1994; 72:687-691.
- 17. Hui Y, Gaffney R, Crysdale WS. Sinusitis in patients witg cystic fibrosis Eur arch Otorhinolaryngol. 1995; 252:191-196.
- 18. Knowler MR, Oliver KN, Hohneker KW, et al. Pharmacologic treatment of anormal ion transport in the airway epithelium in cystic fibrosis. Chest. 1995; 107:71-76.
- 19. Lusk RP. Laryngoscope 100. Endoscopic sinus surgery in children with chronic sinusitis pilot study. June 1990, pp 654-658.
- 20. Cyuler JP. Arch. Otolaryngolo. Head Neck surgery follow-up. Endoscopic sinus surgery on children with CF. 1992; 118: 505-506.
- 21. Nishioka GJ, Barbero GJ, Koning P, et al. Symptom outcome after funtional endoscopic sinus surgery in patients with cystic fibrosis: A prospective study. Otolaryngol. Head and Neck Surg. 1995; 113:440-445.
- 22. Heinz Stamberger. Funtional endoscopic sinus surgery BC Decker 1991.
- 23. Stammberger H, Posa wetz W. Functional endocopic sinus surgery: concep indications and results of the Messerklinger tachnique. Eur Arch Otorhinolaryngol. 1990; 247: 63.
- 24. Moss RB. Immunopathologenesis of cystic fibrosis. Pediatric Respiratory Disease: Diagnosis and treatment. Philadelphia, WB Saunders co. 1993; 674-687.
- 25. Collins FS. Cystic fibrosis: Molecular biology and therapeutic implications Science. 1992; 256: 774-779.
- 26. Friedman WH. Staging of chronic hiperplastyc rhinosinusitis: treatment strategies. Otolaryngol Head Neck Surg. 1995; 112:210-214.
- 27. Boat TF, We sh MJ, and Beaudet AL. Cystic fibrosis. In : serive CL. The methabolic basis of inherited disease. New York: Mc graw Hill. 1989; 2649-2680.
- 28. Quinton PM. Cystic fibrosis a disease in electryte transport. FASEBJ 1990; 4: 2079-3017.
- 29. Stewart B, Zabner J, Shubert AP et al. Normal sweat chloride values do not excluye the diagnosis of cystic fibrosis. AM J. Respir Crit Care Med. 1995;151:899-903.
Fuentes
- 30. Welsh MJ. Abnormal regulation channels in cystic fibrosis epithelia. FASE BJ. 1990; 4:2718-2725.
- 31. Peter Kristidis, Dominique Roozon et al. Genetic deternination of exocrine pancreatic function in cystic fibrosis Am J. Hum Genet. 1992; 50:1178-1184.
- 32. Tsui, LC, M. Bush wald 1991 biochemical and molecular genetics of cystic fibrosis. Adw. Hum Genet. 1996;20:153-266, 311-312.
- 33. Korst RJ, Mcelvaney NG, Mastrangeli et al. Gene therapy for the respiratory manifestations of cystic fibrosis. Am J Respir. Crit Care Med. 1995; 151:575-587.
- 34. Welhs MJ, Fick RB. Cystic fibrosis. J Clin Invest. 1987; 80:1523-1526.
- 35. Evans LR, Linker A. Production and characterization of the slime polysacharide of Pseudomonas aeruginosa J. Bacterial. 1983; 116:915-924.
- 36. Hiby N, Doring G, Schitz PO. Role of inmune complexes in the pathogenesis of bacterial infections. Annu rev Microbiol. 1986; 40:29-53.
- 37. Gary J. Nishioka, Giulio J. Barbero, Peter Kuning et al. Symptom outcome after functional endoscopic sinus surgery in patients wuth cystic fibrosis: A prospective study.
- 38. King WB. Upper respiratory disease sinusitis, and poliposis. Clin Rev Allergy. 1991; 9:143-157.
- 39. Duplechain JK. White JA, Miller RH. Pediatric sinusitis. The role of endoscopic sinus surgery in cystic fibrosis and other forms of sinonasal disease. Arch otolaryngol head and neck surgery. 1991; 117:422-426.
- 40. Amodio JB, Berdon WE, Abramson S, Baker D. Cystic fibrosis in childhood: paranasal sinus and skeletal manifestations. Roatgenol. 1987; 22:125-135.
- 41. Kerrebujun JD, Poublon RM, Overbeek SE. Nasal and paranasal sinus disease in adult cystic fibrosis patients. Eur. Respir J. 1992; 5:1239-1242.
Referencias Bibliográficas
- 42. Cuyler JP. Follow-up of endoscopic sinus surgery on children with cystic fibrosis. Arch otolaryngol Head and Neck Sur. 1992; 118:505-506.
- 43. Jones JW. Parsons DS, Cuyler JP. The results of functional endoscopic sinus (FESS Surgery on the symptoms of patients whit cystic fibrosis) Int J. Pediatrotorhynolaryngol. 1993; 28:25-32.
- 44. Umetsu DT, Moss RB, King WW, Lewinston LJ. Sinus disease in patients with severe cystic fibrosis; relation the pulmonary exacerbation Lancet. 1990; 335:1077-1078.

CLIC AQUÍ Y DÉJANOS TU COMENTARIO