Carcinoma mucoepidermoide de parótida en población pediátrica
Reporte de un caso y revisión de la literatura
Andrés Chala G., MD*,
Jorge Rafael Villamizar, MD**,
Juan P. Cardona, MD***,
Carlos R. Villegas, MD****
* Coordinador Grupo de Cirugía de Cabeza y Cuello. Hospital y Universidad de Caldas.
** Jefe de ORL Hospital de Caldas. Profesor Universidad de Caldas.
*** Oncólogo Clínico Hospital de Caldas.
**** Oncólogo Clínico ION Manizales.
Resumen
El cáncer de glándulas salivares mayores es una patología poco frecuente en la población infantil, siendo el tipo más frecuente el carcinoma mucoepidermoide usualmente de bajo grado de malignidad. Dada su baja presentación, el manejo usualmente se ha extrapolado al de la población adulta. Se presenta el caso de un paciente de dos años de edad con carcinoma mucoepidermoide de alto grado de malignidad, con compromiso del espacio parafaríngeo, manejado por el grupo de cirugía de cabeza y cuello del Hospital y Universidad de Caldas. Se realiza tratamiento quirúrgico con parotidectomía total, preservación del nervio facial faringectomía lateral y vaciamiento radical modificado de cuello. El postoperatorio evoluciona satisfactoriamente, desarrolla fístula faríngea que es manejada con nutrición enteral hasta su cierre. Se realiza radioterapia postoperatoria, con buena evolución.
Palabras clave: Carcinoma mucoepidermoide, parótida.
Caso Clínico
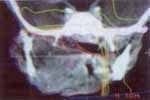
Paciente de sexo masculino de dos años de edad, consulta por sintomatología de tres meses de evolución, consistentes en edema en hemicara derecha, tumefacción de la glándula parótida y submaxilar del mismo lado acompañado de dolor. Inicialmente es manejada como una parotiditis bacteriana con antiinflamatorios y antibióticos (Figuras 1 y 2). Por persistencia de la sintomatología y asociación a otalgia es remitido al servicio de otorrinolaringología, quien encuentra un tumor parotídeo derecho duro firme de 6 x 8 cm. Adicionalmente presenta lesión tumoral que protruye hacia el conducto auditivo externo, con abombamiento de la pared lateral faríngea. Se practica biopsia de lesión del conducto auditivo externo y TAC que confirma el compromiso de la lesión hasta el conducto auditivo, el espacio parafaríngeo sin invasión a la base de cráneo (Figuras 3 y 4).
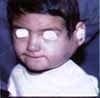
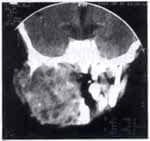
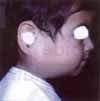
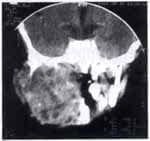
La patología reporta carcinoma mucoepidermoide de alto grado de malignidad. Adicionalmente se realiza Bacaf del tumor parotideo con hallazgos histopatológicos similares. El paciente es remitido al grupo de Cirugía de Cabeza y Cuello, quienes realizan evaluación, encontrando una lesión tumoral de la parótida derecha de 6,5 x 8,0 cm de diámetro, con compromiso subjetivo de la rama marginal del nervio facial y signos inflamatorios de la piel de la región retroauricular, además de compromiso por contigüidad de la glándula submaxilar ipsilateral, sin trismus y presencia de adenopatías múltiples niveles I y II ganglionar ipsilateral de 3 a 6 cm. La radiografía de tórax es reportada como normal. Con diagnóstico de carcinoma mucoepidermoide de alto grado de malignidad T4N2bM0 Estado IV es llevado a cirugía. Como hallazgo intraoeperatorio se encuentra tumor infiltrante de parótida con absceso drenado a piel retroauricular y extensión al espacio parafaríngeo tanto superior como medial y compromiso por infiltración de la rama marginal del facial, y del conducto auditivo externo por infiltración tumoral por contigüidad. Se realiza parotidectomía total con preservación de rama témporo-facial del nervio facial, resección tumoral del conducto auditivo externo (cartilaginoso), submaxilectomía, hemifaringectomía lateral, y vaciamiento radical modificado de cuello (Figuras 5 y 6). La evolución postquirúrgica es satisfactoria, siendo manejado con nutrición enteral por sonda avanzada, antibioticoterapia, atropina y manejo de drenes. El día quinto desarrolla fístula faringo-cutánea que es manejada con tratamiento médico conservador (Figura 7), durante tres semanas aproximadamente.
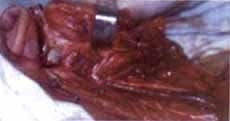
Figura 5.
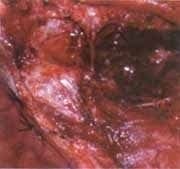
Figura 6.
 Figura 7.
Figura 7.
El reporte final de patología es carcinoma mucoepidermoide de alto grado de malignidad de 7,8 x 6,3 x 4,0 cm con 40 ganglios negativos para malignidad, y borde de resección profundo con enfermedad microscópica.
El paciente es llevado a junta de oncología y de acuerdo al protocolo se programa para radioterapia postoperatoria. Se le plantearon a la familia del menor las consideraciones de índole funcional y estético así como las consecuencias de la radioterapia a largo plazo teniendo en cuenta el compromiso ya relatado en la interpretación del TAC y de los hallazgos intraoperatorios con unos campos de tamaño considerable; se trató inicialmente de hacer una planeación clínica dirigida solamente a las áreas preoperatoria comprometida y luego con los hallazgos postquirúrgicos se definió el campo de tratamiento definitivo, se decidió inicialmente hacer un arreglo de campos basados en un programa de planeación computarizada PLATON con base en los diferentes cortes del escáner y según la mejor definición de campos con el arreglo de ellos con base en mayor peso ipsilateral y con cuñas que ayudarían a la mejor distribución de dosis en el volumen blanco irregular inicial (Figura 8), teniendo en cuenta lo anterior como dosis mínima de 45 Gys y dosis máxima en adultos de 60 Gys nos decidimos plantearle una dosis total de 45 Gys iniciales en dos campos, el primero lateral ipsilateral con 60% de peso y cuña de 30° y un segundo campo anterior simulando el campo de adultos para un cáncer de senos paranasales ampliado con carga del 40% y sin cuñas, luego según la tolerancia y respuesta continuar hasta 60 Gys con reducción del volumen blanco buscando dar la mayor cantidad de dosis a las áreas mayormente comprometidas definidas por los hallazgos intraoperatorios o las que continuaban con reporte de bordes positivos según el informe de patología.
En valoración posterior se evidencia recurrencia tumoral a nivel de base de cráneo con inflitración a meninges y fosa craneal media. Por lo anterior se decide manejo paliativo, con analgésicos además de apoyo psicológico a la familia. El paciente fallece por invasión a estructuras intracraneales y complicaciones pulmonares a los ocho meses del diagnóstico inicial.
Revisión
Los tumores malignos de la parótida son poco frecuentes. Corresponden del 1 a 3% de las lesiones malignas de cabeza y cuello en adultos (1). En la población pediátrica son aún menos frecuentes, con una presentación menor del 1% de las neoplasias malignas de cabeza y cuello, y en menos del 5% ocurren en menores de 16 años y muy raramente en niños menores de dos años (2). Por eso en la población pediátrica una masa parótida tiene 2,5 veces más probabilidad de ser maligna que en el adulto (3), y como tal el 50% de las masas parotideas en niños son malignas (3, 4). De los tumores malignos de la glándula parótida entre 38 y 55% (4, 5) corresponden a carcinoma mucoepidermoide en su mayoría de bajo grado y de grado intermedio de malignidad, y menos de un 20% de alto grado de malignidad. La baja incidencia de esta malignidad en la población pediátrica hace que la experiencia individual o institucional con la evaluación y tratamiento de estas lesiones sea aún más difícil. Los diferentes tipos histológicos así como el comportamiento biológico hacen que las estrategias de tratamiento sean muy variadas. Los tumores más frecuentemente encontrados en las glándulas salivares mayores son los benignos, siendo el adenoma pleomórfico el más frecuente, seguido por los hemangiomas. De los malignos; el más frecuente es el carcinoma mucoepidermoide seguido por el tumor mixto maligno, el adenoide quístico y los rabdomiosarcomas. Las masas parotideas en niños usualmente representan un dilema diagnóstico y terapéutico.
La citología aspirativa con aguja fina es un excelente método para el abordaje inicial el cual, dependiendo de la experiencia del grupo, ofrece una especificidad entre el 85-91% y una sensibilidad del 96-99% (3,5). La misma permite usualmente diferenciar benignidad de malignidad, aunque no siempre es útil para hacer una clasificación más especifica del tumor (3), que depende de la experiencia del que toma la muestra y de la experiencia del citopatólogo.
Una de las dificultades en la población pediátrica son las molestias ocasionadas por el procedimiento, el cual puede hacer necesario un acto anestésico para la toma de la muestra, limitando su utilidad puesto que no cambia la necesidad de la conducta quirúrgica, y favorece en estos casos la realización de una biopsia por congelación para determinar la naturaleza de la lesión y ofrecer la ampliación de un procedimiento quirúrgico que como mínimo siempre corresponde a una parotidectomía superficial. La biopsia incisional está condenada por el riesgo de daño al nervio facial y en las lesiones malignas la diseminación tumoral a estructuras adyacentes (6) y a la alta recidiva para las benignas.
Los estudios de imágenes carecen de especificidad en diferenciar lesiones benignas de malignas (7), igualmente son innecesarias en lesiones pequeñas de la parótida. Para lesiones grandes o con compromiso del espacio parafaríngeo la TAC o la RNM ayudan a planear el procedimiento quirúrgico. El comportamiento de los tumores malignos en niños (8) se relaciona con el tipo histológico y es similar al de las malignidades de la parótida en la población adulta (4,9). El número limitado de pacientes ha hecho difícil obtener conclusiones valederas para la población pediátrica, por lo cual hasta la fecha se recomienda que tales tumores, sean tratados en forma similar a los de la población adulta.
La etiología de los tumores malignos de las glándulas salivares es desconocida, sin embargo, la exposición a la radiación es un factor de riesgo (10), como regla general se manifiestan como una masa no dolorosa de crecimiento lento. Aunque el crecimiento tumoral rápido de la lesión parotídea, o la presencia de parálisis del nervio facial y dolor; son una presentación inusual sugieren la naturaleza maligna de la neoplasia (11). La palpación de adenopatías asociadas puede ocurrir en los casos avanzados y en especial según el grado de indiferenciación. La presencia o ausencia de dolor no diferencia benignidad de malignidad ya que se presenta dolor en 5 a 6% de las masas malignas (12), sin embargo, la presencia de dolor en una lesión maligna empeora el pronóstico (13).
El carcinoma mucoepidermoide posiblemente se origina en las células epiteliales del conducto interlobar o intralobular (14), se reconoce microscópicamente por la mezcla de células productoras de moco con áreas de diferenciación epidermoide y células intermedias. Adicionalmente es dividido en tumores de bajo, intermedio y alto grado de malignidad. Las lesiones más diferenciadas tienden a tener una mayor cantidad de células productoras de moco y las pobremente diferenciadas tienden a ser sólidos con limitada producción de moco con presencia de cordones de células intermedias y epidermoides. Las de alto grado semejan un carcinoma escamocelular a veces con queratinización y áreas focales de hemorragia, necrosis (15,16), asociadas a células anaplásicas, mitosis atípicas, invasión y pleomorfismo nuclear. Tinciones especiales con ácido peryódico de Schiff ayudan a identificar la presencia de glicógeno y mucina producidas por estos tumores. Los de bajo grado de malignidad tienden a estar circunscritos aunque no encapsulados (10) y consistentemente muestran buen resultado después del adecuado manejo quirúrgico, a diferencia del de alto grado de malignidad que tiene un pronóstico pobre usualmente con mínima encapsulación, mayor grado de invasión local y de compromiso ganglionar cercano al 45-48% (5,10,17,18).
La clasificación por estadios de acuerdo a la AJCC (13) permite el establecimiento de protocolos de manejo según cada estadio clínico. Para el tumor primario (T) se considera TX tumor no puede determinarse, T0 sin evidencia de tumor primario, T1 tumor menor de 2 cm sin extensión extra parenquimatosa, T2 tumor de 2 a 4 cm sin extensión extra parenquimatosa, T3 tumor de 4 a 6 cm con extensión extra parenquimatosa compromiso del nervio facial, y T4 tumor mayor de 6 cm, extensión a base de cráneo o compromiso del nervio facial. La evaluación nodal es igual a la de otros sitios de cabeza y cuello e incluye N0 sin metástasis ganglionar, N1 metástasis ganglionar única ipsilateral menor de 3 cm, N2 a metástasis nodal única ipsilateral de 3 a 6 cm, N2b metástasis nodal múltiple ipsilateral menor de 6 cm, N2c metástasis nodal bilateral o contralateral menor de 6 cm y N3 metástasis nodal mayor de 6cm. La enfermedad metastásica a distancia se clasifica como MX cuando no puede ser determinada, M0 cuando no está presente y M1 cuando está presente. Así pues el estado I incluye T1-T2N0M0. El estado II solo T3N0M0. El estado III incluye T1-2N1M0. El estado IV T4N0M0, T3-4N1M0, cualquier T, N2-3, M1.
La extensión de la parotidectomía está determinada por el grado de diferenciación. Para el mucoepidermoide de bajo grado de malignidad en estadios tempranos y menores de 4 cm, la principal indicación es la parotidectomía superficial o total con conservación del nervio facial siempre que sea posible. Para el carcinoma de alto grado de malignidad la parotidectomía total con suficiente margen de resección que deje bordes libres es fundamental teniendo como principio que la radioterapia en niños debe ser evitada hasta donde sea posible. La resección del nervio facial o sus ramas es realizada si hay evidencia clínica o anatómica de compromiso del nervio en el momento de la cirugía. Cuando es necesario el sacrificio del nervio o sus ramas se prefiere la reconstrucción temprana con anastomosis primaria, injertos libres de nervio o transferencias musculares (19). El papel de la disección ganglionar de cuello en la población pediátrica no está claro dada la alta presencia de hiperplasia nodal en este grupo etario (20).En la mayor parte de los centros se recomienda el vaciamiento de cuello en los tumores de alto grado de malignidad o evidencia de enfermedad nodal. Por lo anterior, en los pacientes con carcinoma mucoepidermoide de alto grado de malignidad sin evidencia clínica de enfermedad nodal, debe incluirse una disección electiva del cuello especialmente de los niveles ganglionares I, II y III. La disección supraomohioidea permite la resección de esos grupos con mínima morbilidad. Ante la presencia de enfermedad metastásica nodal establecida clínicamente,es necesario una disección radical o modificada de cuello (11,18).
Dado que el comportamiento biológico es similar al de los adultos (4,5,8,9) las indicaciones de radioterapia posiblemente son similares, pensando en esto se busca primero controlar el sitio primario y las rutas o relevos ganglionares involucrados usualmente empleando cirugía, ocasionalmente radioterapia o ambas modalidades; la consideración acerca del resultado cosmético, funcional, preservación de salivación, calidad de la voz y lo principal, teniendo en cuenta las consecuencias a largo plazo en tejidos óseos, musculares y dentales con el empleo de la radioterapia hacen que la escogencia definitiva sea basada en la preservación de la vida y en segundo plano todo lo anterior cuando se va decidir por radioterapia como modalidad única, en forma neoadyuvante o adyuvante.
Considerando las series en población pediátrica de las glándulas salivares publicadas por el Memorial Sloan-Kattering Cancer Center de New York y el M.D. Anderson Cancer Center en Houston, en el grupo de neoplasias malignas el carcinoma mucoepidermoide es el más común y la primera opción terapéutica la constituye la cirugía, en segundo plano se encuentra la radioterapia con unas claras indicaciones postquirúrgicas:
1. Neoplasia de alto grado de malignidad.
2. Metástasis cervicales iniciales.
3. Márgenes quirúrgicos positivos.
4. Tumor residual postquirúrgico macroscópico.
5. Hallazgos histológicos de agresividad tales como la invasión perineural.
6. Invasión del espacio vascular y linfático.
7. Extensión extraglandular a tejidos blandos.
8. Inoperabilidad.
9. Compromiso del nervio facial (considerado por algunos como criterio máximo inicial).
Uno de los problemas de la radioterapia en la población pediátrica es el potencial de inducir nuevas malignidades y los efectos sobre el crecimiento facial y el desarrollo al igual que efectos secundarios como trismus y osteorradionecrosis (21) por lo cual debe sopesarse riesgo-beneficio.
La quimioterapia está siendo explorada en la paliación, en la enfermedad metastásica a distancia y como terapia adyuvante en el tratamiento del carcinoma de glándula salivar de alto grado de malignidad con protocolos de administración de ciclofosfamida, doxorrubicina y cisplatino (22, 23) y otros de cisplatino, metotrexate, fluoracilo en especial para el carcinoma mucoepidermoide (25).
El grado de diferenciación del carcinoma mucoepidermoide se correlaciona con la invasión local, la incidencia de metástasis nodales y el pronóstico. Para el carcinoma de bajo grado de malignidad la probabilidad de morir a cinco años es de 6% comparada con 65% para el de alto grado de malignidad. En otras series la sobrevida del carcinoma mucoepidermoide de alto grado de malignidad, cae respecto al de bajo grado, dependiendo de los estadios, a cinco años es 100% para el estadio I, 65% para el II y 10% para el III (25).
La rata de recurrencia para el carcinoma mucoepidermoide de alto grado oscila en pacientes tratados solo con cirugía entre 60-75% (26), lo cual justifica radioterapia postoperatoria. Ante la enfermedad nodal metastásica el control locoregional es de 40% para pacientes tratados sólo con cirugía y de 69% para los tratados con cirugía y radioterapia con ratas de sobrevida a cinco años de 19 y 49% respectivamente (27).
La curación depende de las series; Spiro (28) encontró curación del 48% a 15 años para los de bajo grado y de menos de 25% para los de alto grado.
Conclusiones
El carcinoma mucoepidermoide de alto grado de malignidad de parótida es poco frecuente en la población pediátrica. Se presenta con una masa de crecimiento rápido de la glándula e invasión a las estructuras adyacentes. La citología aspirativa es un aceptable método diagnóstico para establecer la naturaleza de la lesión. El tratamiento recomendado es la resección quirúrgica completa, en lo posible con preservación del nervio facial. La asociación de radioterapia postoperatoria no es ideal en niños menores de tres años, pero en este caso está indicada dada la enfermedad microscópica sobre el lecho parotideo y hacia la base de cráneo. Dado el tipo histológico y la agresividad del mismo, el pronóstico es pobre. Debido a la poca experiencia en la población pediátrica con este tipo de tumor, se recomienda aplicar los protocolos de manejo que se han establecido para la población adulta.
Abstract
The salivary gland carcinoma is unusual in the pediatric group. It happens in less than 3% of all of the head and neck malignancies. The most common salivary gland carcinoma is the mucoepidermoide carcinoma. It tends to present slow growing, painless, cystic masses. This histological presentation is divided in low, intermediate and high grade tumors. There is an overwhelming consensus that the tumor grade is a strong predictor of clinical behavior. The high-grade mucoepidermoid carcinoma has an invasive pattern with nodal metastasis, higher rates of recurrence and lower five-year survival rates. Wide excision is the preferred treatment with preservation of the facial nerve unless it is involved. Postoperative radiation therapy is generally recommended. We present a case of a 2- years old child with a high-grade mucoepidermoid carcinoma of the parotid gland that was treated with surgery and radiation therapy due to the aggressive behavior of this tumor. We review the literature related to this unusual tumor in the pediatric group.
Key terms: mucoepidermoide carcinoma
Correspondencia: Dr. Andrés Chala y cols. Clínica Guayacanes; Tel.: 876060 Manizales, Correo luchi14@epm.net.c
Bibliografía
1. Thompson D, McCaffrey T. Surgical Approach for primary parotid malignancies. Operative Techniches in Otolar Head and Neck Surg 1996; 7 (4): 358-364.
2. Luna MA, Batsakis JG, et al: Salivary Gland Tumors in Children. Ann Otol Rhinol Laryngol 1991; 100: 869.
3. Schuller DE, McCabe BF. The firm salivary mass in children. Laryngoscope 1977; 87: 1891-1898.
4. Konno A, Numata T, et al. Treatment of parotid tumor during Childhood. 5th international conference on Head and neck Cancer Aug 2000; 315-321.
5. Orvidas LJ, Kasperbauer JL et al. Pediatric Parotid masses. Arch Otolaryngol Head Neck Surg. 2000; 126: 177-184.
6. Eneroth C, Hamberger C: Principles of treatment of different types of parotid tumors. Laryngoscope 1974; 84: 1732.
7. Grossman RI, Yousem DM. Extramucosal diseases of the head and neck, i8n Neuroradiology: the requisites. St Louis: Mosby-year Book, 1994, 377-412.
8. Bentz B, Hughes A. Masses of the Salivary Gland Region in Children. Arch Otolaryngol Head Neck Surg 2000; 126:1435-1439.
9. Baker SR, Malone B. Salivary Gland Malignancies in Children. Cancer 1985; 55: 1730-1736.
10. Land CE, Saku T, et al. Incidence of salivary gland tumors among atomic bomb survivors, 1950’1987. Evaluation of radiation-related risk. Radiat Res: 1996; 146: 28.
11. Luna Mario. Pathology of Tumors of Salivary Glands. En: Comprehensive Management of Head and Neck Tumors. Thawley. Pangje. Batsakis Second Edition WB Saunders 1999. pg 1106-1146.
12. Eneroth CM: Histological and clinical aspects of parotid tumors. Acta Otolaryngol (suppl 191) pg 1963.
13. Westra WH: The Surgical Pathology of Salivary Gland Neoplasms. Otolaryngol Clin North Am 1999; 32(5): 919-946.
14. Batsakis JG, Regezi JA, Luna MA, et al. Histogenesis of salivary gland neoplasms: A postulate with prognostic implications. J Laryngol Otol 1989; 103: 939.
15. Seifert G, Sobin LH. The World Health Organization’s histological classification of salivary gland tumors. Cancer 1992; 70: 379-85.
16. Dale HR. Malignant Salivary Gland Neoplasms. Otolaryngol Clin of North America. 1999; 32(5): 875-890.
17. Saha J, Thde J. Salivary Gland Tumors. Curr Probl Surg Dec 1990; 779-843.
18. Medina J. Neck Dissection in the treatment of cancer of major salivary glands. Otolaryngol Clin of North America 1998; 31 (5): 815-822.
19. Conley J, Tinsley P Jr. Treatment and prognosis of mucoepidermoid carcinoma in the pediatric age group. Arch Otolaryngol 1985; 111: 322.
20. Callender DL, Frankenthaler RA, Luna MA et al: Salivary Gland Neoplasms in children. Arch Otolaryngol Head Neck Surg 1992; 118: 472.
21. Byers RM, Puiokowski R, Luna MA. Malignant parotid tumors in patient under 20 years of age. Arch Otolaryngol 1986; 110: 232-235.
22. Suen J, Johns M: Chemotherapy for salivary gland cancer. Laryngoscope 1982; 92:235.
23. Johns ME, Goldsmith MM: Incidence, diagnosis and classification of salivary gland tumors. Oncology 1989; 3:47.
24. Kaplan MJ, Johns ME, Cantrel RW: Chemoterapy for salivary gland cancer. Otolaryngol Head Neck Surg 1986; 95: 165-170.
25. Spiro RH, Huvos AF, Strong EW: Cancer of the parotid gland. A clinicopathologic study of 288 primary cases. Am J Surg 1975; 130: 452.
26. Frazell EL: Clinical aspect of tumors of the major salivary glands. Cancer 1954; 7: 637.
27. Armstrong JG, Harrison LB, Spiro RH et al. Malignant tumors of major salivary gland origin. A match pair analysis of the role of combined surgery and postoperative radiotherapy. Arch Otolaryngol Head Neck Surg 1990; 116: 290-293.
28. Sipiro RH, Huvos AG, Strong EW: Mucoepidermoid carcinoma of salivary gland origin. A clinicopathologic study of 367 cases. Am J Surg 1978; 136:301.
CLIC AQUÍ Y DÉJANOS TU COMENTARIO