Dismenorrea Primaria: Pautas de Tratamiento
Si bien anteriormente numerosas formas de tratamiento fueron propuestas, muchas de ellas con el tiempo demostraron ser ineficaces. Hoy día el tratamiento está fundamentalmente dirigido a inhibir la síntesis de prostaglandinas a nivel endometrial4,23,38. Las estrategias terapéuticas recomendadas son los antiinflamatorios no esteroides (AINES) y los anticonceptivos orales combina dos, ya que definitivamente para que el manejo sea exitoso, se deben suprimir las prostaglandinas endometriales23, 35, 47. Desde hace años se ha evidenciado que las mujeres que padecen cuadro de dismenorrea primaria presentan niveles de prostaglandinas significativamente elevados en el flujo menstrual al ser comparados con mujeres normales. Cuando se administran AINES o anticonceptivos orales combinados, ocurre una disminución significativa de las prostaglandinas en el flujo menstrual, hasta niveles más bajos que los existentes en mujeres sin dismenorrea y concomitantemente se va a producir alivio en los síntomas relacionados con la dismenorrea primaria2.
Los antiinflamatorios no esteroides (AINES) tiene ventajas sobre los anticonceptivos orales combinados, ya que sólo necesitan ser administrados por dos o tres días al mes y al disminuir la hipercontractilidad miometrial, mejoran otras manifestaciones de la dismenorrea como: vértigos, náuseas y vómitos48. El aumento en la rata de éxito con el uso de los AINES, ha llevado a que hoy día sean los medicamentos de primera línea y a que una larga lista de productos estén comercialmente disponibles para el manejo de la dismenorrea primaria48. Aquellos casos de falla en la respuesta a los AINES, son los que llevan a pensar que otros mediadores, como los leucotrienos, estén presentes en la fisiopatología de la dismenorrea primaria.
En años recientes han sido publicados estudios donde se evalúan otras alternativas terapéuticas, que son agrupadas bajo el término de alternativas, que si bien no disponen al presente de estudios amplios para ser considerados normas para aplicar, son alternativas para casos seleccionados, mientras se realizan nuevos y más amplios estudios. Los analgésicos narcóticos para el manejo de la dismenorrea serán sólo considerados en circunstancias muy extremas4.
Antiinflamatorios no Esteroides (AINES)
Los antiinflamatorios no esteroides (AINES) son de las drogas más ampliamente prescritas en todo el mundo28. Son productos que disminuyen la síntesis de prostaglandinas, por inhibir la acción de la ciclooxigenasa y se constituyen hoy día en el tratamiento de elección para el manejo de la dismenorrea primaria4. Teniendo en cuenta que la liberación de prostaglandinas en el flujo menstrual llega al máximo en las horas previas o en las primeras horas de iniciada la menstruación, los AINES deberán administrase por 3 ó 4 días, iniciándose antes de la aparición de los síntomas49.
Al grupo de los antiinflamatorios no esteroides, pertenecen una larga lista de productos que en general son agrupados de la siguiente manera:
Derivados del ácido salicílico (ácido acetil salicílico y salicilato de sodio). Sustancias que fueron las primeras en sintetizarse y utilizarse en dismenorrea, pero a la fecha sin indicación al respecto, por los mayores beneficios y menores efectos secundarios de las más recientes moléculas disponibles.
derivados del ácido acético. Entre ellos citamos: Indometacina, Tolmetin, Sulindac, Diflunisal, Diclofenac, Etodolac, Ketorolac y Zimepirac.
Derivados del ácido propiónico. Son muy importantes y con los cuales existe amplia experiencia clínica, sobre todo en manejo de la dismenorrea: Ibuprofén, Naproxén, Fenoprofén, Ketoprofén, Pirprofeno37-38.
Derivados de los Fenamatos. Con una mayor y más amplia aplicación como antiinflamatorios: ácido mefenámico y ácido meclofenámico48.
Derivados del ácido enólico. Entre estos podemos destacar: Piroxican, Tenoxican y Meloxican, sustancias de amplio uso en la actualidad.
Derivados de otros grupos. Nabumetona, Nimesulide, Celecoxib y Rofecoxib. Son los de más reciente síntesis, de amplio uso y atractivos por la menor severidad de los efectos secundarios, debido a la especificidad en el efecto sobre la COX-228,49-50.
Como se ha señalado, los AINES tiene un primer mecanismo de acción en el sistema ciclooxigenasa (COX) inhibiendo la producción de las prostaglandinas28. Se ha sugerido que la favorable acción antiinflamatoria y analgésica de los AINES es debida a la inhibición del sistema de la ciclooxigena-2 (COX-2), mientras que los efectos indeseables son debidos a la concomitante inhibición del sistema ciclooxigenasa-1 (COX-1)28,49-50.
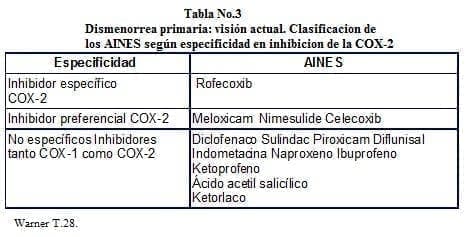
Aquellos AINES que inhiban de forma selectiva la COX-2, inhibirán la síntesis de citoquinas y prostaglandina F-2 alfa en tejidos inflamatorios, y conservarán la línea de la COX-1, evitándose la destrucción de prostaglandina E-2 y prostaciclina que tienen un papel fisiológico3,15. Warner et al28, de acuerdo a la especificidad para inhibir la COX-2, y respetar a la COX-1, clasifica a los AINES en tres grupos. (A) Inhibidores específicos de la COX-2, siendo el principal exponente el Rofecoxib. (B) Preferenciales específicos de la COX-2, integrados por el Nimesulide, Meloxican y Celecoxib. (C) No específicos, donde están incluidos todos los demás AINES. Tabla 3.
Morrison et al3 aseveran que la administración de Rofecoxib a dosis de 25 y 50 mgs ejercen una acción similar a la del Naproxén 550 mgs, para mejorar los síntomas relacionados con la dismenorrea primaria, siendo ambos mucho más eficaces que el placebo. Zhang48 publicó un metaanálisis donde sentencia que el Naproxén, Ibuprofén, Ácido Mefanámico y Aspirina, todos son efectivos en dismenorrea primaria, mientras que el Acetaminofén aparenta ser en gran medida, menos efectivo.
Los AINES disminuyen el tono uterino, disminuyen la frecuencia y amplitud de las contracciones uterinas, disminuyen la isquemia a nivel de la fibra uterina y tejido endometrial, y por todo lo anterior disminuyen la severidad del cuadro de dismenorrea23. Cuando los AINES son iniciados desde el día previo al inicio de la menstruación y administrados por dos o tres días del ciclo, ofrecen una respuesta satisfactoria entre el 75 y 99% de los casos15, como se ha demostrado con el Ibuprofeno, Naproxén e Indometacina5,51. Abu y Konje20 también sostienen que se ha estimado que de 10 a 30% de las pacientes con menstruaciones dolorosas, no mejoran con los inhibidores de la sintetasa de la prostaglandina, y para ellas pueden ser importantes en un futuro, los nuevos antagonistas de los receptores de leucotrienos. Los AINES se contraindican en pacientes con antecedentes de úlceras gastrointestinales o en casos de hipersensibilidad5.
Anticonceptivos Orales Combinados
Por su acción sobre el eje hipotálamo – hipófisis – ovario, los anticonceptivos orales combinados disminuyen la proliferación endometrial, y por la repercusión generada sobre el folículo ovárico disminuyen la síntesis de progesterona con lo cual se tiene un menor sustrato para formación de fosfolípidos, menor síntesis de ciclooxigenasa, menor concentración de prostaglandinas y despeños menstruales mucho más escasos4-5,15. En general, se considera que se produce mejoría en el 90% de las pacientes47,52, siendo por tanto los anticonceptivos orales combinados de microdosis, la primera alternativa de anticoncepción en aquellas mujeres que presentan dismenorrea primaria y que desean a la vez realizar planificación familiar4. Este bien demostrado efecto benéfico de los anticonceptivos orales combinados sobre la dismenorrea primaria, es uno de los beneficios no contraceptivos que tiene la píldora, y que debe ser difundido entre los trabajadores del área de la salud52. No está aún demostrado que los anticonceptivos orales combinados de muy baja dosis, de ultra baja dosis o los anticonceptivos orales trifásicos ejerzan una igual eficacia desde el punto de vista de la mejoría de la dismenorrea.
Si no hay mejoría significativa de la dismenorrea con el uso de los anticonceptivos orales combinados, después de tres meses de uso, pueden agregarse AINES siguiendo los criterios ya establecidos.
Otras Alternativas
Si la mujer no mejora con los AINES o con los anticonceptivos orales combinados, es necesario en primera instancia, una revaloración para colocar en evidencia la posibilidad de alteraciones ginecológicas, o no ginecológicas, siendo el cuadro realmente una dismenorrea secundaria5. La laparoscopia tiene en estos momentos una indiscutible indicación. Dawood5 asevera que al momento de practicar la laparoscopia es conveniente dilatar el cuello hasta el dilatador 10 de Heggar, lo cual lleva al alivio temporal de la dismenorrea por destrucción de fibras y plexos cervicales, con la consiguiente desnervación parcial cervical. Considera además el mismo autor5 que la dilatación aumenta temporalmente el diámetro del conducto endocervical y mejora la expulsión del fluido menstrual, disminuyendo el tiempo de contacto entre las prostaglandinas endometriales y la pared uterina.
Se han propuesto varias alternativas terapéuticas para el manejo de la dismenorrea primaria53-58. En una de ellas, Weingad et al53, después de realizar un estudio randomizado y placebo _ controlado, aseveran en la publicación de marzo del 2001, que el calor continuo y tópico a nivel del hipogastrio es una terapia tan efectiva como el Ibuprofén para el tratamiento de la dismenorrea. Si bien, al igual que el anotado, existen otros estudios publicados a nivel mundial54,57-59, no están disponibles los suficientes resultados con el suficiente argumento que permitan recomendar su uso de forma rutinaria. Las siguientes son las estrategias terapéuticas más difundidas, sin olvidar que deben ser consideradas como alternativas y como tal individualizadas.
- Neurectomía presacra y ablación de los nervios uterinos. En pacientes con dismenorrea primaria, la neurectomía presacra y la ablación de los nervios uterinos, son procedimientos quirúrgicos que deben tenerse en cuenta solamente cuando se ha presentado falla en la respuesta a los tratamientos médicos. La primera técnica fue en los inicios descrita por Jabousay y Ruggi55. La desnervación quirúrgica de la pelvis, conllevaría a la interrupción de la gran mayoría de las fibras nerviosas sensitivas, disminuyéndose por tanto el dolor menstrual. Desde la disponibilidad de la endoscopia operatoria, a la neurectomía presacra por laparotomía se le agregó la realizada por laparoscopia, siendo ambas rutas alternativas importantes para el manejo del dolor pélvico crónico. Fang-ping Chen y Yung-Kueit Song55 en un estudio encontraron mejoría significativa del síntoma doloroso en 64 (77%) de 83 pacientes que presentaban dismenorrea primaria, al ser tratadas con neurectomía presacra por vía laparoscópica. Aseveran los autores55 que las complicaciones agudas y a largo plazo son raras. Por su parte, Wilson et al2 evaluaron las técnicas de interrupción quirúrgica de los nervios de la pelvis, identificando en bases de datos mundiales, los estudios relevantes y adecuadamente controlados, y concluyen en Database Cochrane, que a corto término no hay diferencias entre ablación de los nervios uterinos y neurectomía presacra. Finalizan su artículo sentenciando que son algunas las evidencias que respaldan la efectividad de estos procedimientos quirúrgicos en el manejo de la dismenorrea.
- Tamoxifeno. El Tamoxifeno tiene propiedades antiestrogénicas a nivel del útero, por lo tanto, es un importante inhibidor de la contractilidad del miometrio, y de la vasoconstricción de las arterias uterinas de mujeres no embarazas. Kostrzewska et al56, confirman los anteriores conceptos estudiando In – Vitro tiras de fibras musculares uterinas obtenidas por histerectomía de mujeres premenopáusicas, y postulan que el Tamoxifeno pudiese llegar a tener una potencial importancia para el tratamiento de la dismenorrea. No existen estudios clínicos al respecto.
- Estimulación eléctrica transcutánea de los nervios. La estimulación eléctrica transcutánea de los nervios, TENS (Transcutaneus Electric Nerve Stimulation) no utiliza medicamentos, y es una técnica frecuentemente utilizada por terapeutas físicas. Se considera que el TENS alivia la dismenorrea primaria, ya que el estímulo eléctrico de alta frecuencia bombardea las fibras preganglionares, con lo cual se saturan las neuronas del asta dorsal medular y se bloquea la propagación de los impulsos dolorosos5. Además el TENS induce la liberación de endorfinas en dichas neuronas y ello contribuye adicionalmente a aliviar el dolor5. En un estudio, Dawood y Ramos11 utilizando estímulo eléctrico transcutáneo de nervios, en 32 mujeres por 2 ciclos, obtuvieron excelente mejoría en el 42.2% de las pacientes con dismenorrea primaria. Milsom et al57 compararon en mujeres con dismenorrea primaria, los cambios en la presión intrauterina y la severidad del dolor menstrual, cuando se utilizaba TENS o Naproxén. El Naproxén por vía oral suprimió todos los parámetros de actividad uterina y el dolor se comenzó a reducir entre los 19 y los 120 minutos post administración. Con el TENS el dolor se redujo también significativamente, iniciándose la mejoría entre 30 y 60 minutos post aplicación, pero no hubo cambios en la actividad uterina, lo que permite sustentar que el mecanismo involucrado es una disminución en la transmisión del dolor en el sistema espinal o supraespinal.
- Acupuntura. En 1987, Helms58 publicó resultados utilizando esta milenaria terapéutica y concluye que la acupuntura puede ser exitosa para el manejo de la dismenorrea, al observar que en 43 pacientes, el 90.9% presentó mejoría del cuadro doloroso.
- Dispositivos intrauterinos (DIU) liberadores de levonorgestrel. Existe una amplia investigación relacionada con los dispositivos intrauterinos, en especial con respecto a los síntomas dolorosos que el dispositivo intrauterino liberador de cobre produce. Entre los mecanismos de acción propuestos se establece que el DIU, T de cobre, produce una endometritis aséptica, la cual está relacionada directamente con el aumento del dolor durante el sangrado menstrual. Siendo incluso este método, importante causa de dismenorrea secundaria. Recientemente ha sido introducido el dispositivo intrauterino liberador de levonorgestrel, con el cual se busca fundamentalmente mejorar los efectos secundarios del dispositivo de cobre, como son el aumento del sangrado así como la dismenorrea. El gestágeno de liberación paulatina produce un menor crecimiento endometrial, generándose una pseudo decidualización, la cual disminuye el sustrato para la formación de prostaglandinas con lo cual se mejoran los episodios de dolor59. El dispositivo intrauterino liberador de levonorgestrel es una importante alternativa para aquellas pacientes que desean planificar y no utilizan anticonceptivos orales combinados, o tienen contraindicaciones para este método de planificación. También se puede utilizar el dispositivo intrauterino liberador de levonorgestrel, en aquellas mujeres que presentan dismenorrea primaria severa, o dismenorrea secundaria asociada a endometriosis o al uso del dispositivo intrauterino liberador de cobre.
- Parches de trinitrato de glicerina. Pitrof Et al60 aseveran que el dolor que caracteriza a la dismenorrea está asociado con incremento en la presión intrauterina y los tratamientos efectivos se deben relacionar con relajación de la fibra uterina. Los mismos autores60 consideran que el trinitrato de glicerina es un relajante de la contractilidad uterina, que tiene vida media corta y una rápida dispersión en el torrente circulatorio. Ninguna de las contraindicaciones que tienen los AINES y los anticonceptivos orales combinados, se aplican al trinitrato de glicerina, y por tanto en estas circunstancias pueden ser llamados a tener en cuenta. ya que administrados por vía transdérmica son efectivos para aliviar los síntomas dolorosos relacionados con la dismenorrea. Maya et al23 establecen que el trinitrato de glicerina transdérmico estimula el óxido nítrico endógeno, siendo entonces modulador de la contractilidad uterina, y una alternativa terapéutica diferente.
- Suplementación de Omega-3, un ácido graso poliinsaturado. Los ácidos grasos Omega-3, ácido eicosapentanoico y ácido decosahexanoico, compiten con el ácido graso Omega-6, para disminuir la producción de prostaglandinas y leucotrienos40. El ácido graso omega-3, puede inhibir la formación de ácido araquidónico, resultando en menor producción de prostaglandinas y leucotrienos. Herel et al40 sugieren que la dieta suplementada con ácidos grasos poliinsaturados Omega-3, que están contenidos en aceite de pescado, son efectivos para aliviar los síntomas de la dismenorrea en adolescentes. No hay suficiente información científica publicada al respecto, por lo que muchos más estudios, en diferentes poblaciones son necesarios para determinar la concentración, la frecuencia y la duración en el uso dietario de estas sustancias, para tener un efecto benéfico desde el punto de vista clínico.
Conclusiones
Es imprescindible el adecuado estudio de la paciente que presenta dolor pélvico menstrual. Es fundamental e indispensable alcanzar un diagnostico diferencial entre la dismenorrea primaria y la dismenorrea secundaria, aunque en ocasiones sea difícil de realizar. La correcta y completa realización de la historia clínica es la piedra angular. Debe la semiología aplicarse en toda su magnitud, lo cual incluye un detallado y juiciosamente aplicado interrogatorio, que permita ubicar en su verdadera dimensión a los diferentes síntomas y signos, haciéndose las precisiones respectivas25, 31-32. Es el examen físico fundamental en la valoración del dolor pélvico crónico para diferenciar las causas ginecológicas de las no ginecológicas. La valoración pélvica con el uso de la especuloscopia y el tacto bimanual, así como el tacto rectal, aportan datos orientadores de importancia, y nunca se debe en primera instancia reemplazar por diversos métodos diagnósticos, como la ecografía. La semiología aporta los puntos de partida para la solicitud, ahora sí, de diversos estudios paraclínicos que nos van a llevar a establecer las diferencias entre dismenorrea primaria y secundaria, teniendo presente que algunas de ellas potencialmente pueden producir un impacto negativo en la salud sexual y reproductiva41.
Es importante considerar la necesidad de la laparoscopia en forma temprana en algunas circunstancias, sobre todo si se sospecha la existencia de endometriosis, y siempre que no se consigan buenos resultados con las medidas terapéuticas generales ya señaladas4.
Bibliografía
1. Chen C, Cho S, Damoskosh AI. Prospective study of exposure to environmental tobacco smoke and dysmenorrhea. Environ Health Perspect 2000; 108(11): 1019-1022.
2. Wilson ML, Farquhar CM, Sinclair OJ. Surgical interruption of pelvic nerve Pathways for primary and secondary dysmenorrhea. Cochrane Database Syst Rev 2000; (2): CD001896.
3. Morrison B, Daniel S, Kotey P, et al. Rofecoxib, a specific cyclooxygenase-2 inhibitor, in primary dysmenorrhea: A Randomized controlled trial. Obstet Gynecol 1999; 94(4): 504-508.
4. Schroeder B, Sanfilippo J. Dysmenorrhea and pelvic pain in adolescents. Pediatrics Clinics of North America. 1999; 46 (3): 555-571.
5. Dawood MY. Dismenorrea. Clínicas Obstétricas y Ginecológicas. 1990; 1: 167-176.
6. Mish PC (eds): Webster`s Ninth New Collegiate Dictionary, Springfield, Massachusettz, Merriam – webster, inc, 1986; 331.
7. Smith RP. Dolor pélvico cíclico y dismenorrea. Clínicas de Ginecología y Obstetricia Temas actuales. 1993; 4: 739-750.
8. Jacobson E, Lackner JE, Sinykin. Electrical and mechanical activity of the human non – pregnancy uterus. AM J Obstet Gynecol 1939; 38: 1008-1011.
9. Liessé A. L’áctivite electrique de l’úterus dans la dysmenorrhea functionalle. Gynecol et Obstett. 1948; 47: 850-854.
140. Woodbury RA, Torpin R, Child GP, et al. miometrial physiology and its relation to pelvic pain. JAMA 1947; 134: 1081.
11. Dawood MY, Ramos J. Transcutaneous electrical nerve stimulation (TENS) for the treatment of primary dysmenorrhea. A randomized crossover comparison with placebo, TENS and ibuprofen. Obstet Gynecol. 1190; 75: 656-662.
12. Pickles VR, Hall WJ, Best FA. Prostaglandin’s in endometrium and menopausal fluid from normal and dysmenorrhea subjects. J Obstet Gynecol Br Comm. 1965; 72: 185-193.
13. Pickles VR. Prostaglandin’s and dysmenorrhea: historical survey. Act Obstet Gynecol Scand 1979; 87 (suppl): 58: 7-12.
14. Dawood MY. Dysmenorrhea and Prostaglandin’s: Pharmacological and therapeutic considerations. Drugs 1981; 22: 42-52.
15. Sánchez F. Dismenorrea IN: Botero J, Jubiz A, Henao G. Obstetricia y Ginecología. Texto integrado 6ª Edición. Medellín. 1999.
16. Akerlund M, Stromberg P, Forling MD. Primary dysmenorrhea and vasopresin. Br J Obstet Gynecol 1979; 86: 184-192.
17. Brouard R, Bossmar T, Fournie-Loret D, et al. Effects of SR49059, an orally active V1a vasopresin receptor antagonist, in the prevention of dysmenorrhea. BJOG 2000; 107(5): 614-619.
18. Valentin L, Sladkevicius P, Kindahl H, et al. Effect of a vasopresin antagonist in women with dysmenorrhea. Gynecol Obstet Invest 2000; 50(3): 170-177.
19. Wiener J. Chronic pelvic pain. Practitioner 1994; 238: 352-355.
20. Abu JL, Konje JC. Leukotrienes in gynecology: the hypothetical value of anti- Leukotrienes therapy in dysmenorrhea and endometriosis. Hum Reprod Update. 2000; 6(2): 200-205.
21. Harel Z, lilly C, Riggs S, et al. Urinary Leukotrienes (LT3 4) in adolescents with dysmenorrhea: a pilot study. J Adolesc Health 2000; 27(3): 151-154.
22. WU D, Wang X, Chen D, et al. Metabolic gene polymorphism’s and risk of dysmenorrhea, Epidemiology 2000; 11(6): 648-653.
23. Maya RA, Moisa CF, Morales F, et al. Transdermal glyceryl trinitrate in the management of primary dysmenorrhea. Int J Gynecol Obstet 2000; 69(2):113-118.
24. Mathias SD, Kuppermann M, Liberman RF, et al. Chronic pelvic pain: Prevalence, health related quality of life and economics correlates. Obstet Gynecol 1996; 87: 321-327.
25. Nolan TE, Elkins TE. Choronic pelvic pain. Differentiating anatomic from functional causes. Postgrad Med. 1993; 94: 125-128.
26. Jamieson DJ, Steege JF. The prevalence of dysmenorrhea, dyspareunia, pelvic pain and irritable bowel syndrome in primary care practices. Obstet Gynecol 1996; 1: 55-59.
27. Mahmood TA, Templeton AA, Thomsom L, et al. Menstrual symptoms in women with pelvic endometriosis. Br J Obstet Gynecol 1991; 98: 558-563.
28. Warner T, Giuliano F, Voinovic I, et al. Nonsteroid drug selectivity’s for cyclo – oxigenase-1 rather than cyclo-oxigenase 2 are associated with human gastrointestinal toxicity: a full in vitro analysis. Proc Natl. Acad Sci. 1999; 96: 7563-7568.
29. Fry RP, Crisp AH, Beard RW, et al. Psychosocial aspects of chronic pelvic pain, with special reference to sexual abuse. A study of 164 women. Postgrad Med J 1993; 69: 566-574.
30. Waller KG, Shaw RW. Endometriosis, pelvic pain and psychological funcctioning. Fertil Steril 1995; 63: 796-800.
31. Zondervan K, Yudkin P, Vessey MP. The prevalence of chronic pelvic pain in women in the United Kingdom: A systematic review. Br J Obstet Gynecol 1998; 105: 93-99.
32. Beard RW, Reginald PW. Chronic pelvic pain. IN: shaw RW, Soutter P, Stanton Sl (Eds). Gynecology. Edinburgh. Churchill Livingstone. 1992; 777-789.
33. Monterrosa A. Dolor pélvico crónico: Diagnóstico diferencial. Selecta Médica. 1997; 8(1): 26-29.
34. Wilson C, Emans SJ, Mansfield J, et al. The relationship of calculated percent body fat, sports participation, age, and place of residence on menstrual patterns in healthy adolescent grils at an independent. New England high school. J Adolesc Health care. 1984; 5: 248-253.
35. Harlow S, Park M. A longitudinal study of risk factors for the occurrence, duration and severity of menstrual cramps in a cohort of college women. Br J Obstetric and Gynaecol 1996; 103: 1134 – 1142.
36. Dmitrovic R. Transvaginal color doppler study of uterine blood flow in primary dysmenorrhea. Act Obstet Gynecol Scand 2000; 79 (12): 1112-1116.
37. Jay MS, Durant RH, Shoffitt T, et al. Differential response by adolescents to naproxen sodium therapy for spasmodic and congestive dysmenorrhea. J Adolesc Health Care 1986; 7(6): 395-400.
38. Dawood MY. Dysmenorrhea. J Reprod Med. 1985; 30: 154-162.
39. Balbi C, Musone R, Menditto A, et al. Influence of menstrual factors and dietary habits on menstrual pain in adolescence age. Eur J Obstet Gynecol Reprod Biol. 2000; 91(2): 143-148.
40. Herel Z, Biro F, Kottenhahn R, et al. Supplementation with omega-3 polyunsaturated fatty acids in the management of dysmenorrhea in adolescents. Am J Obstet Gynecol 1996; 174: 1335 -1338.
41. Davies L, Gangar KF, Drummmond M, et al. The economic burden of intractable gynecological pain. J Obstet Gynecol 1992; 12 (S): 54-56.
42. Sundell G, Milsom I, Andersch B. Factors influencing the prevalence and severity of dysmenorrhea in young women. Br J Obstet Gynecol 1990; 97: 588-594.
43. Dawood My. Ibuprofen and dysmenorrhea. Am J Med. 1984; 77: 87-92.
44. Parazzini F, Tozzi L, Mezzopane R, et al. Cigarrete smoking, alcohol consumption and risk of primary dysmenorrhea. Epidemiology 1994; 5: 469-472.
45. Andersch B, Milsom I. An epidemiologic study of young women with dysmenorrhea. Am J Obstet Gynecol 1982; 144: 655 -661.
46. Harlow SD, Matanoski GM. The association between weight, physical activity and stress and variation in the length of the menstrual cycle. Am J Epidemiol 1991; 133: 38-49.
47. Sulak P, Ceressman B, Waldrop E, et al. Extending the duration of active oral contraceptive pills to manage hormone withdrawal symptoms. Obstet Gynecol 1997; 89: 179-183.
48. Zhang WY, Wan P. Efficacy of minor analgesics in primary dysmenorrhea: a systematic review. Br J Obstet Gynecol 1998; 105: 780-789.
49. Brooks P. Use and benefits of Nonsteroidal anti inflammatory drugs. Am J Med. 1998; 104(3S): 9-13.
50. Frohlich JC. Prostaglandin endoperoxide syntethase iso enzymes: the clinical relevance of selective inhibition. Ann Rheum Dis. 1995; 54: 942-943.
51. Chan WY, Fuchs F, Powel AM. Effects of Naproxen sodium on menstrual prostaglandin’s and primary dysmenorrhea. Obstet Gynecol 1983; 61: 285-293.
52. Monterrosa A. Nuevos conceptos en Anticonceptivos orales combinados. 3ª Eds. Bogotá. 2001.
53. Akin MD, Weingand DA, Hengehold DA, et al. Continuous low-level topical heat in the treatment of dysmenorrhea. Obstet Gynecol 2001; 97(3): 343-349.
54. Nezhat CH, Seidman D, Nezhat F, et al. Long term outcome of laparoscopic presacral neurectomy for the treatment of central pelvic pain attributed to endometriosis. Obstet Gynecol 1998; 91: 701-704.
55. Fang-Ping C, Yung-Kuei S. The efficacy and complications of laparoscopic presacral neurectomy in pelvic pain. Obstet 1997; 90: 974-977.
56. Kostrzewska A, Lauddañsski T, Batra S. Potent inhibition by tamoxifen of spontaneous and agonist induced contractions of the human myometrium and intramyometrial arteries. Am J Obstet Gynecol 1997; 176: 381-386.
57. Milsom I, Hedner N, Mannheimer C. A comparative study of the effect of high intensity transcutaneous nerve stimulation and oral naproxen on intrauterine pressure and menstrual pain in patients with primary dysmenorrhea. Am J Obstet Gynecol 1994; 170 (1 pt1): 123-129.
58. Helms JM. Acupuncture for the management of primary dysmenorrhea. Obstet Gynecol 1987; 69: 61 – 69.
59. Vercellini P, Aimi G, Panazza S, et al. A Levonorgestrel releasing intrauterine system for the treatment of dysmenorrhea associated with endometriosis: a pilot study. Fértil Steril 1999; 72: 505-508.
60. Pitroff R, Lees C, Thompson C, et al. Crossover study of glyceryl trinitrate patches for controlling pain in women with severe dysmenorrhea. BMJ 1996; 312: 884.
CLIC AQUÍ Y DÉJANOS TU COMENTARIO