Diabetes Mellitus y Cirugía: Criterios Diagnósticos
En 1997, los expertos del comité asesor de la OMS y la AAD, propusieron nuevos criterios para el diagnóstico de la DM y definieron la enfermedad como la presencia (en dos o más ocasiones) de una glicemia en ayunas superior a 126 mg/dL (> 7 mmol/L), en lugar de los 140 mg/dL que era el punto de referencia que se había establecido. De otra parte, las cifras de glicemia entre 110 mg/dL y 125 mg/dL, corres-ponden a la categoría de “glicemia alterada en ayunas”. Hace diagnóstico de DM, el hallazgo de una glicemia (200 mg/dL (11,1 mmol/L) 2 horas después de una carga de 75 gm de glucosa oral (1.75 g/kg de peso). Esta prueba debe ser reservada, preferiblemente, para los casos en los cuales la glicemia en ayunas no es conclusiva, pero puede ser utilizada como único criterio en estudios epidemiológicos. Es diagnóstico de diabetes una glicemia (de 200 mg/dL, rea-lizada en cualquier momento del día sin tener en cuenta la última comida, en un individuo que presente síntomas de diabetes (poliuria, polidipsia, polifagia, etc.). La intolerencia a la glucosa se diagnostica si se encuentra una glicemia entre 140 mg/dL (7.8 mmol/L), y 199 mg/dL (11,1 mmol/L) a las 2 horas de una carga oral de 75 g de glucosa, siempre y cuando la glicemia basal sea menor de 126 mg/dL.
Los expertos revisaron la clasificación etiológica de la enfermedad y definieron la diabetes tipo 1, como aquella que se presenta a cualquier edad y es el resultado de la destrucción autoinmune de los islotes pancreáticos; en consecuencia, para efectuar el diagnóstico definitivo hay que detectar marcadores de autoinmunidad. En cuanto a la diabetes tipo 2, ocurre por defectos en la secreción de insulina, en pacientes con resistencia previa a la acción de la hormona (Nomenclatura 2).
La prueba debe ser realizada de acuerdo con los criterios de la OMS, utilizando una carga de glucosa equivalente a 75 g de glucosa anhidra disuelta en agua.
Fisiología de la Glucosa
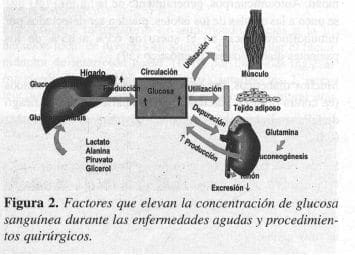
La glucosa es una molécula no ionizada de 6 átomos de carbono. Debido a que no libera iones de hidrógeno no provoca acidosis, aun con concentraciones sanguíneas muy altas. La tendencia de los diabéticos para desarrollar hiperglicemia durante una enfermedad aguda que necesita intervención quirúrgica, podría ser causada por varios mecanismos: mayor producción de glucosa, disminución de la utilización tisular y de la depuración renal de la glucosa (Figura 2).
Los efectos perjudiciales de la hiperglicemia son secundarios a la actividad osmótica de la glucosa, que provoca desplazamiento del agua entre los compartimentos del cuerpo e induce a una diuresis osmótica. Esos desplazamientos ocurren porque ésta se mueve libremente por todos los tejidos del cuerpo, mientras que el transporte de la glucosa, a través de las membranas celulares, depende de múltiples factores de los cuales la insulina no es el menos importante. Se presenta diuresis osmótica considerable siempre que la concentración de glucosa plasmática excede el umbral renal de la misma (aproximadamente 180 a 250 mg/dL). La diuresis osmótica provoca pérdida de agua, lo cual, a su vez, produce deshidratación y excreción de numerosos iones con el agua (sodio, potasio, cloruro, magnesio y fosfato), que tendrán efectos nocivos sobre el volumen vascular y la función de la membrana celular.
Fisiología de los Cuerpos Cetonicos
El término “cuerpos cetónicos” se refiere generalmente a tres moléculas diferentes, pero relacionadas: acetona, ácido aceto – acético y ácido beta – hidroxibutírico (83). Los dos últimos no son tóxicos per se, pero producen efectos nocivos por medio de su disociación (ionización) a nivel del pH del cuerpo (o sea, 7.4) en iones de hidrógeno y en los acetoa-cetato y beta -hidroxibutirato. Si se permite que se acumulen, los iones hidrógenos bajan el pH sanguíneo, lo cual produce acidosis sistémica que tendrá numerosos efectos nocivos sobre la función celular y, al final, provoca colapso cardiovascular.
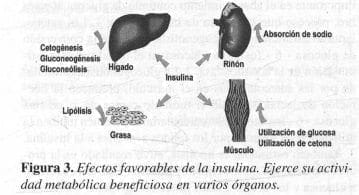
Durante el período perioperatorio es importante medir los cuerpos cetónicos cada 6 horas utilizando las tabletas Acetest. Si el sujeto es hiperglicémico e hipercetonémico, la dosis de insulina debe aumentarse (Figura 3).
Si el paciente presenta glicemia normal y es hipercetonémico, entonces la dosis de insulina también debe ser aumentada (aproximadamente 0.25 U por hora), agregándole glucosa intravenosa adicional para prevenir una hipoglicemia. La cetosis de larga duración es perjudicial debido a la acidosis que produce. Como la insulina es la principal hormona inhibidora para la formación de los cuerpos cetónicos,su presencia durante la operación quirúrgica a partir de la producción endógena de las células beta o de la venoclisis exógena es indispensable para prevenir la cetoacidosis.
Complicaciones de la Diabetes Mellitus
Las complicaciones de la diabetes mellitus (DM) son agudas y crónicas. Las agudas son básicamente, la cetoacidosis diabética (de importancia en el diabético tipo 1), el estado no cetósico hiperosmolar (más frecuente en el diabético tipo 2), los estados metabólicos mixtos y los cuadros de hipogli-cemia resultante del tratamiento médico intensivo.
Las complicaciones de la DM, no sólo deterioran la calidad de vida del individuo y le causan la muerte, sino que su manejo es la mayor fuente de consumo de recursos. El compromiso microvascular es causa de ceguera y de insuficiencia renal. La microalbuminuria, definida como la excreción urinaria de 30 a 200 mcg/min de albúmina, o entre 30 a 300 mg en orina de 24 h, es una condición que antecede el desarrollo de nefropatía franca.
Por su parte, la enfermedad macrovascular se ve favorecida por la presencia de factores de riesgo aterogénicos como son, obesidad, sedentarismo, hipertensión, dislipidemia e hiperfibrinogenemia. Además, la DM es la causa más frecuente de amputaciones de miembros inferiores debido a la oclusión vascular progresiva y al desarrollo de neuropatías y de complicaciones infecciosas (pie diabético).
Fisiopatología de las Complicaciones Agudas de la Diabetes Mellitus
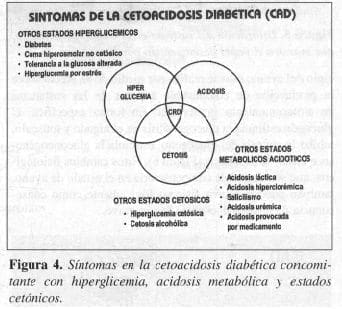
La cetoacidosis diabética (CAD) y el coma hiperosmolar no cetósico (CHNC), son dos de las complicaciones agudas más comunes de la DM que tienen desenlaces fatales, si no son tratados rápidamente. La cetoacidosis diabética se ca-racteriza por hiperglicemia, acidosis y cetosis (Figura 4)
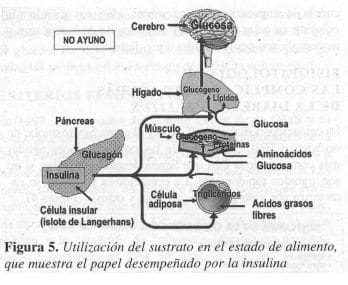
Recordemos los cambios fisiológicos de la glucosa en los estados de alimentación normal y de ayuno (33, 53). Des-pués de la ingestión de una comida, los carbohidratos, las proteínas y las grasas son convertidas en glucosa, aminoácidos y ácidos grasos libres, respectivamente. La insulina desempeña el papel principal en la utilización de la glucosa, aminoácidos y ácidos grasos, en el estado de no ayuno. Los valores adecuados de insulina aseguran el almacenamiento de glucosa como glucógeno en el hígado; de aminoácidos como proteínas en el músculo; y de ácidos grasos libres como triglicéridos en la grasa (Figura 5). El glucagón, la hormona catabólica más importante, es suprimida en el estado de alimentación. Al declinar el nivel de la glucosa sanguínea un lapso después de la comida, se reduce la secreción de insulina y sube el nivel de glucagón.
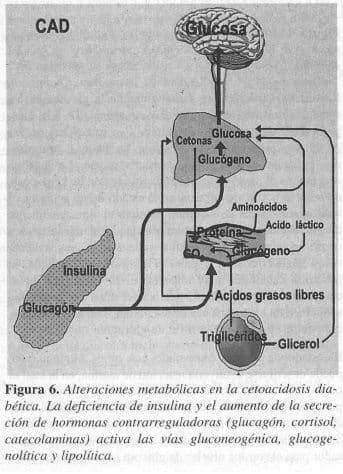
El estado de ayuno, comparado con el de alimentación, puede describirse como una reacción de alarma, en la cual el organismo utiliza sus defensas metabólicas y hormonales para proteger el cerebro de la lesión hipoglicémica. El nivel de la insulina es suprimido; en este momento el glucagón desempeña un papel considerable en un intento compensador para elevar los niveles de glucosa en la sangre al principio del ayuno; esto se realiza por medio de su efecto sobre la producción de combustible a partir de las sustancias de almacenamiento intracelular. En forma específica, el glucagón estimula la glucogenólisis en el hígado y músculo, inhibe la síntesis del glucógeno, estimula la gluconeogénesis e inhibe la glucólisis (Figura 6). Estos cambios fisiológicos, que son de índole compensatoria en el estado de ayuno, también pueden ocurrir fisiopatológicamente como consecuencia de infección, estrés o lesión grave.
La cetoacidosis diabética, representa un ejemplo aún más extremo del estado de ayuno, debido a la falta total de insulina, un estado de superayuno, en el cual el organismo por medio de un aumento exagerado de glucagón, dirige todos los recursos hacia la producción de glucosa, como si se tratara de asegurar sustrato suficiente para el cerebro (30).
La segunda reacción hormonal en la CAD es un aumento de las cetecolaminas, que normalmente desempeñan un papel importante en el abastecimiento continuo de glucosa al cerebro, proceso que se realiza de tres maneras: 1. Las catecolaminas estimulan la glucogenólisis mediante la conversión de glucosa – 6 – fosfato a glucosa en el hígado, por la esti-mulación de la adenilciclasa. 2. La glucogenólisis, estimulada por las catecolaminas en el músculo, producen la libe-ración de lactato, porque el músculo carece de la enzima glucosa – 6 – fosfatosa. Las catecolaminas también inhiben la utilización de glucosa por los tejidos sensibles a la insulina. 3. También estimulan la lipólisis, cuyo resultado es la producción de ácidos grasos libres y glicerol. Este es convertido a glucosa y los ácidos grasos libres en cuerpos cetónicos en el hígado. Como las reservas de glucógeno son limitadas, la gluconeogénesis es el mecanismo principal, por medio del cual se conserva la euglicemia durante el ayuno prolongado o la cetoacidosis diabética (CAD).
En presencia de niveles suprimidos de insulina, el cortisol desempeña un papel más indirecto en la compensación del bajo nivel de glucosa sanguínea en el estado de ayuno, estimulando la producción de aminoácidos a partir de los músculos, que sirven como el mayor sustrato para la gluconeogénesis.
Después de un ayuno prolongado, los cuerpos cetónicos son utlizados para el cerebro, como un sustrato alternativo de la glucosa, ahorrando así las reservas de proteínas que, por otra parte, son necesarias para sostener la producción basal de glucosa mediante la gluconeogénesis. Por lo tanto, el estado durante la administración del alimento, es un sistema de metabolización de los carbohidratos, mientras que el estado de ayuno es, principalmente, un sistema de metabolización de grasas y proteínas.
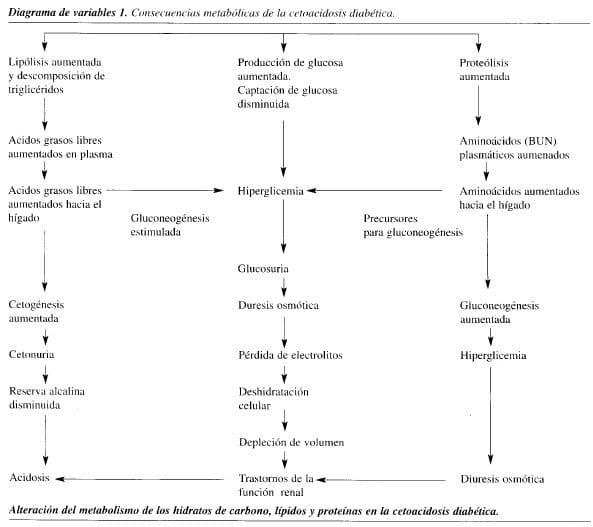
La CAD se caracteriza no sólo por un metabolismo anormal de la glucosa, grasas y proteínas, sino también por trastornos de electrolitos y agua, debidos especialmente a la hiperglicemia, la glicosuria y la diuresis osmótica concomitante. Esta diuresis se manifiesta por poliuria y polidipsia, y puede dar lugar a grandes pérdidas de sodio y potasio (Diagrama de variables 1).
El síndrome de coma hiperosmolar no cetósico (CHNC) con hiperglicemia, se puede definir como un estado hiperosmolar, consecutivo a hiperglicemia de varias causas (72). Dentro de éstas, la más frecuente es la diabetes tipo 2 no diagnosticada, en la cual el paciente tarda en acudir al médico. Entre los factores precipitantes cabe mencionar la infección, el uso de esteroides, la coexistencia de una enfermedad renal, diálisis peritoneal, hiperalimentación, infarto del miocardio, neumonía Gram negativa seguida de uremia y vómitos.
Se han propuesto tres posibles mecanismos para explicar su aparición y para diferenciarlos de la cetoacidosis diabética: 1. Los niveles de hormonas contrarreguladoras son más bajos que en la CAD (31). 2. La secreción de insulina es más alta en el CHNC, en tal forma que habría insulina circulante residual suficiente para prevenir la lipólisis, pero no lo bastante para evitar la produción hepática exagerada de glucosa y para facilitar la utilización de ésta en los tejidos periféricos (31) 3. El estado hiperosomolar puede inhibir la lipólisis, lo cual disminuye el suministro de ácidos grasos libres al hígado, con grado mínimo de cetogénesis (31).

CLIC AQUÍ Y DÉJANOS TU COMENTARIO