Cuantificación del Factor de Necrosis Tumoral en Tejido Pulpar y Lesiones Periapicales
* Dr. Jairo Sarmiento Marín
Odontólogo, Universidad Nacional de Colombia.
Especialistas Endodoncia U.J.
**Dr. Carlos Arturo Guerrero
Médico, Universidad del Valle, Instituto de Genética,
Universidad Nacioanl de Colombia.
N. De la R. Publicamos a continuación los trabajos ganadores del Premio a la investigación “Rafel Torrés Pinzón”, en su séptima edición entregada en Cartagena durante el XVIII Congreso Nacional y IV Internacional “Ramón Viaña Olaya”; en Agosto de 1994.
NOTA: Esta investigación fue realizada con el auspicio de CINDEC y COLCIENCIAS
INTRODUCCIÓN
Los procesos inflamatorios constituyen una de las primeras líneas de defensa del organismo contra los antígenos(1). Este proceso se define como el conjunto de mecanismos de los tejidos vivos frente a la agresión, que determinan en los sistemas hemostáticos de la sangre y en el tejido conectivo, una serie de cambios vasculares encaminados a eliminar el agente y a reparar el daño tisular producido por él.
El proceso como parte del mecanismo de defensa inmune es normal y en consecuencia benéfico para el organismo. No obstante, en algunas condiciones se desencadena innecesariamente o se prolonga en forma indebida, dando lugar a daño tisular y a manifestaciones clínicas importantes(2).
La falta de una oportuna resolución del proceso inflamatorio por persistencia del antígeno o agente agresor dentro de los tejidos, o por deficiencia de alguno de los mecanismos hemostáticos encargados de controlar el proceso, da lugar a la inflamación crónica(2).
Permitiendo la aparición de la respuesta inmunológica específica tanto humoral como celular. Numerosos estudios indican que la respuesta inmunológica humoral ocurre tanto en pulpitis como en las periodontitis apicales(3)(4)(5). También se ha demostrado que las pulpas inflamadas y los granulomas periapicales están equipados con células capaces de iniciar la respuesta inmune, como son: Macrófagos, linfocitos y células plasmáticas.(6).
Aunque las patologías periapicales son lesiones muy comunes, los mecanismos patológicos que son responsables de su expansión no han sido bien definidos. Se ha postulado que su progresión es acompañada y probablemente regulada por la velocidad con que se reabsorbe el tejido óseo circundante.(7).
En los estados inflamatorios los macrófagos activados producen una variedad de citoquinas que alteran la actividad celular. Estos mediadores de la respuesta inmune del huésped a antígenos exógenos incluyen: interferones, interleuquinas y el factor de necrosis tumoral(8).
Recientemente se ha demostrado que la interleuquina 1 (IL-1) y el factor de necrosis tumoral (TNF), influyen en la rebsorción ósea (9)(10).
Thomson y colaboradores(11) sugieren que el TNF y IL-1 ayudan a la reabsorción ósea por activación de los osteoblastos para estimular reabsorción ósea osteoclástica.
Dado que los macrófagos constituyen una parte de los tejidos inflamatorios crónicos tanto pulpares como periapicales, es razonable deducir que ellos secretan la interlequina 1 y el TNF, y así se puede concluir que estas citoquinas podrían potencializar la respuesta inmunológica y promover la reabsorción de los tejidos duros tanto del diente como del tejido óseo.
A pesar de que la bioquímica y la biología celular del TNF han sido ampliamente estudiadas, poca atención se ha prestado sobre la existencia de estos factores en tejidos pulpares y periapicales tanto sanos como inflamados, lo que no ha permitido claridad sobre los factores etiológicos de la enfermedad pulpar y periapical (En general consecuencia casi inmediata e indeseable de la caries, motivo actual de consulta odontológica en aproximadamente un 60% de los casos con pronóstico dudoso en la mayoría de las veces).
Este estudio se realizó en pacientes que asisten a la consulta de las clínicas de la Facultad de Odontología-Universidad Nacional donde se establecieron grupos así:
Grupo No. 1. 10 pulpas permanentes clínicamente sanas tomadas de los pacientes de la Facultad que necesitaban tratamiento de endodoncia con fines restaurativos.
Grupo No. 2. 10 pulpas temporales sanas.
Grupo No. 3. 10 pulpas temporales clínicamente sanas.
Grupo No. 4. 10 lesiones periapicales de pacientes a los cuales se les realizó cirugía apical.
Ningún paciente tenía compromiso sistémico.
Todas las muestras fueron congeladas a -70° C. Una vez recolectadas, se descongelaron y homogenizaron y después se cuantificaron las concentraciones de factor de necrosis tumoral mediante Elisa.
Posteriormente los resultados fueron analizados estadísticamente mediante un análisis de varianza, el cual permitió determinar las diferentes concentraciones de TNF tanto a nivel pulpar como periapical.
ANTECEDENTES Y JUSTIFICACIÓN
La caries que es un patología considerada como de las más comunes en el ser humano por su alta prevalencia (en Colombia tiene una alta morbilidad del 94%), es uno de los factores etiológicos más importantes de la inflamación pulpar y periapical.
Esta se puede definir como una degeneración progresiva y localizada de los dientes, que se inicia por desmineralización superficial por ácidos orgánicos, como el láctico, elaborados por microorganismos de la placa(12). Muchos de ellos en especial streptoccocus mutans, producen ácidos. Su fuente nutritiva la constituyen carbohidratos fermentables como la sacarosa(13).
La dinámica o patogenia de la produción de inflamaicón pulpar por la caries ha sido ampliamente estudiada: este factor etiológico es considerado como un irritante microbiano. En 1959 Orland y colaboradores no encontraron formación de caries en dientes de animales libres de gérmenes, incluso cuando recibieron dietas cariogénicas. No obstante, se formó caries cuando se introdujeron microorganismos a su ambiente.
Cuando se inicia la desmineralización de los tejidos duros del diente, se activan los mecanismos de defensa del tejido pulpar contra el agente agresor, que han sido reportados así:
Mineralización de los túbulos dentarios para disminuir la permeabilidad del diente lo que trata de impedir el paso de microorganismos, y fué descrita por Trowbridge como formación de dentina esclerótica(14).
Si el proceso carioso sigue avanzando los odontoblastos se degeneran y se forman vías muertas en los túbulos dentinarios, según lo encontrado por diversos investigadores mediante el uso de microscopía electrónica. Los mismos investigadores reportan la formación de una dentina neoformada que ha sido denominada como dentina reparativa o irritacional. Este es otro frente defensivo contra el avance de la caries dental.
Paralelamente a los fenómenos anteriores se ha encontrado acumulación de células inflamatorias en el tejido pulpar subyacente a la dentina afectada(16)(17).
Los estudios con microscopía electrónica muestran microorganismos, inclusive bajo lesiones cariosas poco profundas(18)(19).
El Doctor Torneck y colaboradores observaron que a medida que el proceso carioso se acerca al tejido pulpar, los vasos pulpares se dilatan y hay presencia de células inflamatorias tanto agudas (polimorfonucleares neutrófilos) como crónicas (macrófagos, plasmocitos y linfocitos)(19).
Así mismo utilizando técnicas de inmunohistoquímica se han detectado anticuerpos contra los antígenos de la caries dental, lo mismo que componentes del complemento en el tejido pulpar inflamado(20)(21).
Utilizando la técnica de radioinmunoensayo inmunoabsorbente, se evaluó la presencia de anticuerpos tanto en pulpas normales como inflamadas contra microorganismos aislados de caries profundas. La presencia de anticuerpos en las pulpas normales implica un posible papel protector durante los procesos invasivos de la caries(22).
El Doctor Seltzer y colaboradores describen los procesos evolutivos de la inflamación pulpar con la formación de un tejido inflamatorio crónico que progresivamente involucra todo el tejido pulpar del diente y éste a diferencia de los demás tejidos conectivos del organismo se encuentra localizado dentro de paredes rígidas que son las estructuras dentarias y por lo tanto se dá lugar a la necrosis del tejido pulpar, por isquemia o pérdida del aporte sanguíneo. Los procesos inflamatorios se extienden gradualmente al tejido periapical a través del foramen apical, dando lugar a una lesión que en sus estadios iniciales será aguda y después crónica(23).
Varios estudios se han realizado para analizar el contenido tanto microorganismos como de componentes inmunológicos en las lesiones periapicales. De los cuales mencionaré algunos a continuación.
En 1947 y más tarde en 1951, utilizando técnicas se detectó la presencia de microorganismos en las lesiones periapicales(24)(25). Esto fué confirmado por Winkler y colaboradores los cuales utilizando una tinción de gramm modificada para tejidos periapicales demostraron la presencia de bacterias en 87% de 15 casos examinados bajo un microscopio de luz.
La presencia de bacteroides intermedios en los tejidos de granulomas periapicales se demostró mediante una técnica de inmunofluorescencia indirecta, utilizando técnicos de cultivos tanto de anaerobios como aerobios se examinaron 58 lesiones periapicales que requerían cirugías periapicales.
Encontrándose bacterias en todas las lesiones estudiadas.
Los componentes celulares de las lesiones periapicales también han sido estudiados. A continuación se describen algunos de los estudios reportados en la literatura.
En 1969 estudios que usaron una técnica de anticuerpos en tejidos de quistes periapicales demostraron la presencia de inmunoglobulina A y en menor cantidad de Ig M. Esto fué confirmado pro estudios inmunoquímicos realizados por Skaug en 1973 en los cuales encontró que las inmunoglobulinas G, A, y M, estaban presentes en fluidos de quistes periapicales no queratinizados.
Técnicas de inmunofluorescencia fueron usadas para investigar la presencia de componentes de la respuesta humoral (Ig A, M y E) en 13 lesiones periapicales de dientes extraídos. 10 especímenes fueron clasificados histológicamente como granulomas periapicales.
Microscópicamente estas lesiones consistían de tejido conectivo, con un infiltrado de células plasmáticas, linfocitos y neutrófilos. Dos de las muestras fueron clasificadas como quistes periapicales y consistían en cavidad quística delimitada con epitelio y tejido conectivo, alrededor con células plasmáticas y linfocitos. Una última muestra se clasificó como tejido conectivo de cicatrz apical.
Después de la exodoncia de los dientes, las lesiones periapicales fueron removidas, fijadas y teñidas con los conjugados específicos que son: Antihumano IgA, Antihumano IgG, Antihumano C3 y Antihumano C4, del complemento, y se cuantificó la inmunofluorescencia resultante.
Los resultados dieron mayores concentraciones de Ig G y en menos cantidad la presencia de Ig A e Ig E. La conclusión fué que las lesiones periapicales pueden contener todos los componentes necesarios para la respuesta inmune del huésped.
De manera similar mediante el examen inmunocitoquímico con anticuerpos monoclonales se determinó la presencia y distribución de células inmunes, incluyendo linfocitos, macrófagos y células de langerhans en ligamentos periodontales normales, granulomas y quistes periapicales.
La muestra utilizada en este estudio consistió de: Especímenes de ligamento periodontal cureteado de 7 terceros molares extraídos de adultos jóvenes, 13 quistes periapicales, 4 quistes dentígeros, 3 queratoquistes y 2 quistes nasopalatinos y fueron coleccionados después de la remoción quirúrgica.
La mitad de cada muestra fue congelada en nitrógeno líquido y almacenada a -80° C, y la mitad remanente fue procesado en parafina para examen histológico.
Pocos linfocitos T pero no B fueron detectados en especímenes de ligamento periodontal no inflamado. Se encontró un incremento en el nDemero de linfocitos T y B hallados en todas las lesiones examinadas, lo mismo que monocitos, macrófagos y células de Langerhans. Ellos sugieren que la presencia de células inmunes en al lesiones periapicales conlleva la existencia en estas patologías de mediadores inmunológicos producidos por las mismas.
En los últimos años el interés de la investigación de las lesiones periapicales se ha centrado hacia el estudio de los mediadores de la inflamación, utilizando la técnica de los Anticuerpos monoclonales, y eso se demuestra con los siguientes estudios:
Los doctores Baumgartner y Falker cuantificaron PGE2 en lesiones apicales crónicas y agudas mediante la cuantificación de anticuerpos monoclonales con la técncia de radioinmunoensayo (RIA).
El proceso de radioinmunoensayo para determinar la cantidad de pGE2 sintetizada fue realizado de acuerdo a los procedimientos descritos en el Kit Comercial de new England Nucleo Co (E.I. Dupont de Nemours y Co., Inc., Nen Pdoducts, Billerica, MA).
La cantidad de radioactividad fue medida usando un contador gama por un período de 1 minuto. La evaluación de las diferencias estadísticas fueron realizadas mediante un análisis de varianza.
En los resultados se encontraron bajos niveles de PGE3 en las lesiones crónicas, mientras que en las lesiones agudas se encontraron mayores concentraciones, confirmando el papel de las protoglandinas en la patogénesis de las lesiones periapicales humanas.
INTERLEUKINAS EN INFLAMACIÓN
Las monoquinas tales como la Interleuquina 1 y el factor de necrosis tumoral, median un amplio espectro de efectos biológicos. Algunas de estas son producidas por macrófagos. y se ha demostrado que inducen reabsorción ósea osteoclástica.
Su producción es estimulada por factores exógenos y endógenos producidos por bacterias, virus y tumores. Los lipopolisacáridos son un potente estímulo para la biosíntesis del TNF. En la circulación los lipopolisacáridos son un potente estímulo par la biosíntesis del TNF.
En la circulación los lipopolisacáridos se unen a una proteína transportadora y este complejo interactúa con el CD14 (receptor de membrana) sobre la membrana de los macrófagos e inducen la síntesis del TNF. Después de la inducción se estimula la expresión del gen TNF y grandes cantidades de la proteína es liberada hacia la matriz extracelular.
El TNF inicialmente existe como una molécula de 26K asociada a la membrana celular. Este TNF es procesado por un clivaje proteolítico y da un péptido de 17 Kd. 3 moléculas de éstas se unen en forma de complejo homotrimétrico que es biológicamente activo.
El TNF tiene un comportamiento característico cuando es estimulada su producción en los tejidos, cuando se administran dosis intravenosas de endotoxinas, niveles altos del TNF son detectados a las 4-6 horas, pero su se administra en forma constante el lipopolisacárido (Ag) se observa una disminución en las concentraciones del TNF.
FUNCIONES DEL TNF
La acción biológica de esta glicoproteína depende de la concentración en que se encuentra. A bajas concentraciones tiene las siguientes funciones:
- Facilitan la adhesión de los neutrófilos a las células endoteliales. Esta acción contribuye a la acumulación de leucocitos en la inflamación.
- El TNF es un potente activador de los neutrófilos.
- Estimula macrófagos y otras células a producir citokinas incluyendo IL-1, IL-6.
- Puede funcionar como un coestimulador para activación de células T y B.
- Ejerce un efecto protector contra virus similar al del interferon.
En concentraciones altas tiene otras funciones:
1. Pirógeno endógeno.
2. Estimula producción de proteínas de la fase aguda de la inflamación.
3. Puede activar el sistema de la coagulación, principalmente por alteración del balance de la actividad procoagulante y anticoagulante del endotelio vascular.
La otra función que tiene la molécula de TNF es la de producir activación del osteoclasto en los procesos de reabsorción ósea.
El TNF induce la liberación de calcio del tejido óseo in vitro y puede jugar un papel importante en una variedad de enfermedades inflamatorias donde se involucra el proceso de reabsorción ósea.
Los lipopolisacáridos producidos por las bacterias están relacionados con la producción de periodontitis apical y con la reabsorción ósea.
El tejido inflamatorio presente en la periodontitis apical crónica es poblado predominantemente por macrófagos. Se debe esperar por lo tanto, que altos niveles de TNF pueden estar presentes en los tejidos periapicales de los dientes con patologías periapicales.
Se han realizado algunos estudios para cuantificar el TNF en tejido pulpar y lesiones apicales, uno de ellos es el de Kamran y colaboradores que estudiaron la presencia de factor de necrosis tumoral en exudado de lesiones periapicales de dientes que eran clínicamente asintomáticos, pero con necrosis pulpar. Al examen radiográfico se onbservaba imagen radiolDcida a nivel periapical.
Las muestras se toman inmediatamente después de la apertura cameral. Como grupo control se utilizaron 5 dientes que no tenían evidencia de patología pulpar o periapical, pero que necesitaban tratamiento convencional de endondoncia. En este caso las muestras fueron tomadas de los fluidos tisulares dentro de los conductos radiculares después de la extirpación pulpar.
Los dientes utilizados en la muestra fueron aislados con tela de caucho y desinfectados con solución de Iodine al 5%, se realizaron las aperturas con fresa redonda No. 2 y se obtuvo la longitud de trabajo (conductometría) mediante radiografía periapical, seguidamente fue introducida una punta de papel dentro del conducto radicular y cada una de ellas una vez retirada fue colocada en un tubo estéril. Posteriormente las muestras fueron llevadas al laboratorio y mantenidas a 4° C hasta ser analizadas para la presencia de TNF.
Para ésta cuantificación se utilizó un ensayo inmunoabsorbente utilizando anticuerpo monoclonal anti-TNF de la siguiente manera:
Cada cono de papel fue colocado en tubos separados a los cuales se les adicionó medio de cultivo (PBS) mas suero fetal bovino al 2%. Las muestras se incubaron a 37° C por una hora. Las puntas de papel fueron removidas y al medio se le adicionó en Anticuerpo Monoclonal TNF en una solución de 0.1 molar. Sse incubó nuevamente la muestra a temperatura ambiente durante 4 horas, se realizaron 4 lavados con medio de cultivo y posteriormente se le adicionó el Anti-TNF de conejo marcado con Peroxidasa y se cuantificó la reacción colorimétrica de cada una de las muestras mediante un colorímetro.
En los resultados se reporta la presencia de TNF en diferentes concentraciones, siendo más alta en procesos inflamatorios que en los grupos control. Recomiendan el estudio del TNF mediante al obtención de muestras en forma directa, es decir, corte de lesiones periapicales para poder cuantificar con mayor exactitud la presencia de TNF.
TÉCNICAS UTILIZADAS EN LA DETECCIÓN DE SUSTANCIAS
Como el objetivo de este estudio es el de detectar y cuantificar la cantidad de TNF en el tejido pulpar y periapical, se revisaron los conceptos fundamentales para la técnica de Ac monoclonales, como también la preparación de las muestras.
Casi siempre las técncias de análisis cualitativo o cunatitativo para la detección de sustancias, requieren que las moléculas a analizar estén en una solución acuosa o en un solvente sobre lípidos, si son de naturaleza lipídica. Cuando las sustancias a estudiar están en un medio biológico líquido, como por ejemplo en el plasma sanguíneo, el trabajo de la preparación está simplificado porque las moléculas ya están disueltas.
Por el contrario, si las sustancias no están en solución, es indispensable extraerlas, es decir, someter el tejido macerado a la acción de una solución conveniente en la cual, al cabo de unas horas, al agitar la molécula a estudiar, estará solubilizada. Por ejemplo, se pueden extraer ciertas moléculas con una solución neutra de baja concentración (NaCl, 0.1 M/1to).
La solución más elemental consiste en utilizar reactivos como la azida de sodio (NaN3) al 0.02% y condiciones físicas que no alteren la molécula buscada, operando el material como mínimo, en una cámara fría a 4° C, lo que impide la mayor parte de las proliferaciones bacterianas.
Si la molécula buscada está muy ligada a la estructura celular, es necesario separarla por medio de una solución detergente. Los detergentes son moléculas preparadas por síntesis orgánica que tienen propiedades anfipáticas.
Es decir, sus moléculas se asocian a los lípidos por un extremo de la molécula y al agua por el otro extremo cargado eléctricamente. Esta sustancias son en consecuencia, capaces de unirse a las materias lipídicas y de llevarlas en solución acuosa.
Algunos detergentes tienen una acción desnaturalizante que se debe tener en cuenta cuando se están aislando proteínas.
Los detergentes pueden ser iónicos (aniónicos) y no iónicos (no aniónicos). Los primeros suelen ser más activos y más efectivos en la solubilización de proteínas, produciendo un mayor grado de desnaturalización, según sea su concentración. Los más usados principalmente para procedimientos de electroforesis, son el Dodecil Sulfato Sódico (SDS) y el Deoxicolato de Sodio.
Los “no iónicos” son comúnmente usados para solubilizar proteínas de membranas o para solubilizar proteínas de una forma tal que no afecte la “actividad biológica” de la proteína. El mas comúnmente usado es el Tritón X-100 utilizado para solubilizar tejidos, en los cuales se quiere detectar proteínas por métodos de inmunoensayo como el de ELISA.
La técnica utilizada en el presente estudio fue la de cuantificación de Acs policlonales mediante la técnica de Elisa.
Para entender los fundamentos de la metodología utilizada en la investigación, debemos revisar los conceptos básicos de las reacciones antígeno-anticuerpo.
ANTICUERPOS MONOCLONALES
Se parte de dos principios fundamentales:
- Una célula (linfocito B) produce anticuerpos específicos para cada antígeno, de acuerdo con la teoría de la selección clonal de Burnet.
- Se requiere la hibridización de células productoras de anticuerpos con células de mieloma para generar hidridomas en los cuales estén combinadas las virtudes de secreción de un anticuerpo, con el crecimiento continuo. Una posterior selección y clonaje de las células híbridas permite la derivación de anticuerpos monoclonales de una especificidad predefinida y con la actividad deseada.
La producción de Anticuerpos Policlonales es otra técnica usada para la cuantificación de sustancias, basada también en la combinación entre antígeno y anticuerpo.
Los anticuerpos policlonales son obtenidos de suero de animales previamente inmunizados con la sustancias (Antígeno) que se va a cuantificar.
La obtención de Anticuerpos se basa en el principio de que el sistema inmune de los mamíferos, cuando es estimulado por la presencia de un antígeno, sintetiza anticuerpos específicos contra éste, los cuales van a estar en latas concentraciones en el plasma.
Para que se produzca un anticuerpo específico por esta técnica, lo ideal es utilizar el antígeno “puro” para inmunizar el animal (conejo), con lo cual se logra una mayor especificidad, ya que, si bien los anticuerpos monoclonales son más específicos, existen circusntancias en las cuales ésta puede ser menos precisa que la esperada y donde la reactividad cruzada puede ser mayor de la que tiene el suero normal.
La técnica de Ac policlonales tiene la ventaja de ser mas sencilla, requiere un menor tiempo y es más económica que la técnica de anticuerpos monoclonales.
Además no es tan susceptible a ser afectada por las condiciones ambientales, tales como la temperatura y el pH, a diferencia de la técnica con Ac monoclonales, que es muy sensible.
Estos parámetros nos llevaron a escoger la técnica de Anticuerpos Policlonales para nuestro estudio.
Para la detección de anticuerpos policlonales, el método de ELISA (Enzime Linked Inmuno Absorbent Assay) o método Inmuno Enzimático en fase sólida, para Antígenos Solubles es le más utilizado, por su sensibilidad, sencillez y rapidez.
Esta prueba se basa en la capacidad que tiene la placa de microtitulación de adherir fuertemente las proteínas uniendo en cada pozo hasta nanogramos de proteína. Los anticuerpos (del suero en Ac policlonales) reaccionarán con el antígeno adherido a los pozos y esta unión se revelará con un segundo anticuerpo o la proteína A marcados con una enzima, las má usadas son: la fosfatasa alcalina y la peroxidasa.
El grado de unión del anticuerpo se evalúa midiendo el color desarrollado luego de la adición del sustrato y cromógeno (sc) correspondiente al sistema: el nivel del color presente es proporcional al nivel de enzima unido al anticuerpo.
Para la medición del color se utilizan detectores automáticos que permiten la lectura, registro y tabulación de los resultados de los pozos(24).
MATERIALES Y MÉTODOS
Se seleccionaron 10 pulpas de dientes permanentes y 10 pulpas de dientes temporales clínicamente sanos y cuyas pruebas de sensibilidad corroboraron que las pulpas estaban vitales. 14 pulpas con diagnóstico clínico de pulpitis irreversible, y 12 lesiones periapicales crónicas de origen endodóntico.
Para la recolección de las muestras del Primer y Segundo Grupo, se tuvo como parámetros de diagnóstico clínico, dientes que no tenían ningún proceso carioso y a los cuales se les realizó pruebas de sensibilidad eléctrica mediante un vitalómetro y la respuesta fue comparada con el diente contralateral.
Una vez establecido el diagnóstico de pulpa clínicamente sana, se anestesió al paciente con Xilocaína al 2% con Epinefrina, posteriormente se realizó la apertura se realizó la apertura coronaria con fresa redonda No. 2 refrigerada y alta velocidad, una vez terminada la apertura se procedió a la extirpación del tejido pulpar mediante una sonda barbada. El tejido pulapr extirpado se colocó en un tubo de ensayo con 2mm de medio de cultivo (RPMI) y las muestras se congelaron a -70° C dentro de los 60 minutos siguientes. Se esperó hasta recolectar todas las muestras para empezar su procesamiento.
Para el Tercer Grupo, se tomaron dientes cuyo diagnóstico clínico con base en los signos y síntomas fue de Pulpitis Irreversible Aguda. Se anestesió al paciente, se realizó la apertura coronaria, la extirpación de tejido pulpar y se colocó en el medio de cultivo de manera similar al Grupo No. 1.
Para el Grupo No. 4, se tomaron lesiones periapicales de origen endodóntico (Se excluyeron los compromisos de origen periodontal) de dientes que tenían indicado tratamiento quirúrgico periapical.
Se tomó radiografía periapical del diente afectado, posteriormente bajo anestesia local se diseñó un procedimiento quirúrgico de acceso y visibilidad al área apical, con una mínima manipulación de esta zona. Seguidamente con una cureta de lucas la lesión apical fue removida e introducida en un frasco estéril con 2ml de PBS y antes de una hora fueron congelados a -70° C.
Una vez recolectadas todas las muestras se procesaron así: Se descongelaron los vials con las muestras, se sacaron los especímenes completos y/o fragmentados, se pesaron en una balanza de precisión, luego cada muestra se colocó en un eppendorff que contenía 1 ml de una solución de PBS con 2 ul (microlitros) de azida de Na al 0.02%.
Se esperó una hora y luego se llevó al homogenizador mecánico de émbolo donde se homogenizó hasta solubilizar el tejido en la solución. Pasó a un eppendorff y se centrifugó a 50.000 RPM en la microcentrífuga por dos minutos. Se almacenaron todas las muestras a 4° C hasta el día siguiente, en el que se inició el procedimiento para realizar la técnica de ELISA.
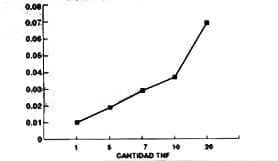
Relación entre concentración de TNF y la Absorción
(Controles Positivos):
| CANTIDAD TNF (X) | ABSORBANCIA (Y) |
| 20 ng 10 ng 7 ng 5 ng 1 ng |
0.069 0.037 0.028 0.018 0.009 |
DETECCIÓN Y CUANTIFICACION DEL TNF MEDIANTE LA TÉCNICA DE ELISA (ENSAYO INMUNO ENZIMATICO EN FASE SOLIDA PARA ANTIGENOS SOLUBLES)
- Se montaron 96 pozos de ELISA en un marco de portapozos en cada una de las pruebas.
- Se colocaron 100 microlitros por pozo, de soluciones de antígeno, de TNF puro por duplicado en las columnas No. 1 y No. 2 a diferentes concentraciones: 1.000, 500, 250, 100, 50, y 25 nanogramos.
- Se colocaron 100 microlitros en las columnas restantes, del sobrenadante de cada una de las muestras por duplicado y a tres diferentes diluciones en PBS puro: 1:1 y 1:10.
- Se colocaron 100 microlitros en tres pozos del sobrenadante de una solución preparada macerando una hoja en pBS, como control negativo.
- En los pozos sobrantes se colocaron 100 microlitros de PBS como blancos y a continuación se cubrieron para evitar la evaporación (controles sin antígeno).
- Se incubó a 37° C por una hora, se dejó toda la noche a 4° C y luego una hora a 37° C.
- Se removió al antígeno no unido, volteando de un solo movimiento el marco con los pozos y se lavó tres veces con 100 microlitros de PBS-Tween, dejando 1 minuto entre cada lavado.
- Se colocaron 100 microlitros de una solución de suero de conejo No. 2 con PBS, en dilución de 1:500, en todos los pozos (antisuero).
-
Se incubó a 37° C por una hora y media.
- Se removió y se lavó con PBS Tween, por tres veces como el número 7.
- Se colocaron 100 microlitros de una solución fresca de Proteína A con Fosfatasa Alkalina en PBS (1 ul por 1 ml respectivamente), en todos los pozos.
- Se incubó a 37° C por 40 minutos.
- Se removió y se lavó por tres veces con pBS-Tween.
- Se colocaron 100 microlitros de la solución reveladora recién preparada en cada uno de los pozos.
- Se dejó temperatura ambiente hasta que se desarrolló el color, usualmente una hora y media.
- Se añadieron 50 microlitros de solución frenadora.
- Se leyó en el lector de ELISA a 405 manómetros.
RESULTADOS
Cuando se realizaron todos los ELISA y se realizó la lectura de la absorbancia en todos los pozos, los resultados fueron consignados en un formato diseñado previamente los cuales se detallan en la Tabla No. 1 donde observamos la absorbancia dada por las diferentes concentraciones de TNF usadas como controles positivos y en las tablas No. 1-2-3-4 donde se describen laos datos de: Diagnóstico, No de la muestra, peso, absorbancia y concentración de TNF.
Tabla No. 1.
ANALISIS ESTADISTICO
Dx |
No. Muestra |
Peso Total |
Absorbancia Total |
Absorbancia 1 mgr |
( ) de TNF |
X |
PERMANENTESSANAS |
121617182021222427 |
7.4450.6433.0039.491.2332.28.107.038.19 |
0.0220.1080.0390.0150.0920.1080.1040.0080.004 |
0.0000.00210.00110.0000.0000.00320.01280.00110.0001 |
0000002.5700 |
0.285 |
Tabla No. 2.
Dx |
No. Muestra |
Peso Total |
Absorbancia Total |
Absorbancia 1 mgr |
( ) de TNF |
X |
TEMPORALES |
13141519232526 |
-2.054.6051.014.1121.6817.4912.0 |
-0.063-0.0060.0260.0090.1960.027-0.009 |
0.00.000.00050.00210.00900.00150.000 |
00001.3900 |
0.198 |
Tabla No. 3.
Dx |
No.
|
Peso Total |
Absorbancia Total |
Absorbancia 1 mgr |
( ) de TNF |
X |
PU L
|
353637383940414243444546 |
7.2815.501.456.585.906.3218.610.0316.76.785.01.32 |
0.2240.1400.0780.1990.0940.2110.1840.2410.1200.0540.0870.061 |
0.03070.09650.05370.03020.02590.03330.00980.02400.000710.001740.001740.0462 |
8.13628.5715.277.983.248.941.6456.050.84.0064.00612.95 |
8.49 |
Tabla No. 4.
Dx |
No. Muestra |
Peso Total |
Absorbancia Total |
Absorbancia 1 mgr |
( ) de TNF |
X |
LESIÓNAPICALCRÓNICA |
4748495051525354555657 |
11.2412.8525.528.0344.3718.0622.447.549.4715.6620.02 |
0.2580.2240.3150.1750.0120.1920.2280.2020.0740.1030.180 |
0.02290.01740.01230.02170.00020.01060.01010.2670.00780.00650.0089 |
5.714.0064.425.3401.891.736.891.020.621.36 |
2.81 |
Como teníamos valores conocidos de absorbancia de diferentes concentraciones de TNF decidimos utilizar el análisis de regresión y así poder estimar la concentración de TNF en las diferentes muestras teniendo como variable dependiente la absorbancia.
Como se tenían diferentes absorbancias para una misma muestra, se escogió el valor máximo de ésta en cada muestra para elaborar un gráfico de dispersión (gráfico A).
Gráfico A.
Relación entre la concentración de TNF y la Absorbancia
(Controles Positivos)

De acuerdo a este gráfico se obtuvo un modelo general que se expresa así:
y = M X +b
y= 0.00452 + 0.00322 X
Donde y = Absorbancia de las muestras y la concentración de TNF va a estar dada por X, es decir
| ………….y – 0.00452 X = ______________ ……………0.00322 |
Por medio de este modelo podemos estimar la concentración de TNF de cada una de las muestras y así podemos realizar comparaciones de los valores estimados de TNF entre los grupos experimentales.
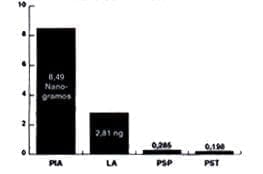
Se estimó en 0.285 ngr el promedio de concentración de TNF para pulpas permanentes sanas, de 0.198 ngr para pulpas temporales sanas, para las lesiones apicales de 2.81 ngr y para las pulpas con diagnósticos de pulpitis irreversible aguda de 8.49 ngr de promedio de TNF.
Estos promedios fueron comparados entre sí como se observa en las tablas No. 5 y 6 y en el gráfico No. 1.
Tabla No. 5. Resultados.
PROPORCIÓN DE CANTIDAD DE TNF EN PULPITIS
IRREVERSIBLE AGUDA Y LESIONES APICALES.
| _ X TNF P.I.A……………………………………….8.49ng =======================================….= 3.021 _ X TNF LESION APICAL…………………….2.81ng |
Tabla No. 6. Resultados.
PROPORCIÓN DE CANTIDAD DE TNF EN P.I.A.
y PULPAS PERMANENTES SANAS.
| _ X TNF P.I.A……………………………………….8.49ng =======================================….= 29.78 _ X TNF PULPAS SANAS……………………0.285ng |
Gráfica No. 1. PROMEDIO CONCENTRACIÓN DE TNF.
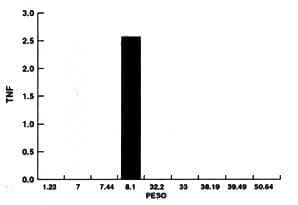
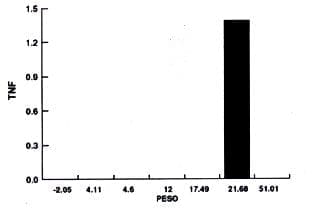
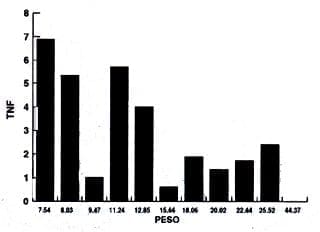
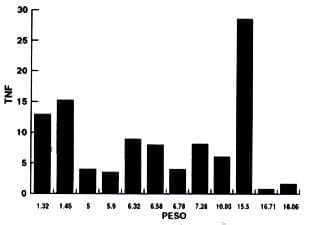
También se realizó otro análisis de los resultados basados en la relación entre el peso de la muestra y la concentración de TNF de los diferentes grupos experimentales y estos resultados se detallan en los gráficos No. 2-3-4 y 5. De acuerdo a esto no se encuentra una relación entre la concentración de TNF y el peso de las muestras.
Gráfica No. 2.
Permanentes sanas
Proporción peso/Concentración TNF
Peso |
( ) TNF |
1.237.07.448.1032.233.038.1939.495.64 |
0002.5700000 |
Gráfica No. 2.
Permanentes sanas.
Gráfica No. 3.
Temporales sanas
Proporción peso/Concentración TNF
Peso |
( ) TNF |
-2.054.114.6012.017.4921.6851.01 |
000001.390 |
Gráfica No. 3.
Temporales sanas.
Gráfica No. 4.
Lesión Apical
Proporción peso/Concentración TNF
Peso (X) |
( ) TNF (Y) |
7.548.039.4711.2412.8515.6618.0620.0222.4425.5244.37 |
6.895.341.025.714.0060.621.891.361.732.420 |
Gráfica No. 4.
Lesión Apical
Gráfica No. 5.
Pulpitis Irreversible Aguda
Proporción peso/Concentración TNF
Peso (X) |
(Y)( ) TNF |
1.321.455.05.96.326.586.787.2810.0315.5016.7018.6 |
12.9515.274.0063.548.947.984.0068.1366.0528.570.801.645 |
Gráfica No. 5.
Pulpitis Irreversible Aguda
ANÁLISIS DE LOS RESULTADOS
Pulpas Temporales y permanentes Sanas:
La cuantificación de TNF en pulpas de dientes temporales y permanentes sanos fue cero con excepción de dos muestras en las cuales la concentración de TNF está en bajas cantidades (2.57 y 1.39 ngr).
Pulpas Permanentes con diagnóstico clínico de Pulpitis Irreversible Aguda:
No hay ninguna relación entre peso y cantidad de TNF. En su lugar existe una diversidad en la respuesta de las muestras con respecto a la producción de TNF. En este grupo se encontró la concentración más alta de TNF con respecto a los otros grupos experimentales.
Lesiones Apicales Crónicas:
Como ocurrió con la pulpitis irreversible aguda, no hay relación entre peso y cantidad de TNF, medido por la técnica de ELISA. Sin embrago, contrasta con ésta en que los valores de TNF hallados son menores y las diferencias entre dichos valores no son tan amplias como las pulpitis irreversibles agudas.
Los valores encontrados de TNF son menores que los de pulpitis irreversible aguda pero significativamente mayores que los de las pulpas temporales y permanentes sanas. Esto se observa por la comparación proporcional de las concentraciones estimadas de acuerdo a las tablas No. 5 y 6.
DISCUSIÓN
agresor (antígeno), se observa la presencia de mediadores químicos los cuales median una serie de mecanismos intercelulares como: comunicación entre célula y célula, activación celular, amplificación de la respuesta inmune facilitando procesos como la quimiotaxis, opsonización y fagocitosis. Así mismo, act Dan como agentes mitogénicos y de crecimiento de las células de defensa.
Dentro de estos mediadores se encuentran las citoquinas producidas por cierto grupo de células y dentro de éstas se ubica el TNF producido principalmente por los macrófagos activados. Su producción está controlada por varios factores que están a su vez regulando la expresión del gen del TNF.
Así mismo la producción de TNF, básicamente se restringe a procesos inmunológicos que conlleven un estímulo por agresión celular (Factores irritativos o infecciosos) produciendo inflamación.
Esto concuerda con los resultados de nuestro estudio en el cual, la cuantificación de TNF en pulpas sanas de dientes temporales y permanentes fue de cero con excepción de dos muestras. Esto significa que no hay expresión del gen en pulas clínicamente sanas. Las dos excepciones encontradas puede obedecer a procesos inflamatorios no detectados clínicamente o a un factor de error de muestreo en el desarrollo de la técnica de ELISA.
De acuerdo a los resultados obtenidos en las pulpas con diagnóstico de pulpitis irreversible aguda, no hay ninguna relación entre peso y cantidad de TNF, en su lugar existe una diversidad en la respuesta de las muestras con respecto a la producción de TNF.
Lo anterior indica que puede existir una variabilidad en los estadios inflamatorios por heterogeneidad en la expresión del gen.
Probablemente la heterogeneidad en la respuesta de la expresión del gen (niveles variados de TNF) se dá por la heterogeneidad en los factores que estimulan dicha expresión genética que son:
Calidad, número y tiempo de presencia del antígeno que también pueden indicar estadios agudos y crónicos de inflamación.
Así mismo como ocurrió con la pulpitis irreversible aguda en las lesiones apicales no hay relación entre el peso de la muestra y la cantidad de TNF. Sin embargo contrasta con la pulpitis irreversible aguda en que los valores de TNF son menores (3.5 veces menor cantidad) y las diferencias entre las muestras no son tan amplias como en la pulpitis irreversible aguda.
Esto es un hallazgo importante pues si se tiene en cuenta que en la lesión apical hay mayor daño tisular y reabsorción de los tejidos duros por activación de osteoclastos a partir de citoquinas como la Interleukina 1 y el TNF, se esperaba que la producción del TNF fuera mayor en esta lesión.
Se debe tener en cuenta que este es un tejido granulomatoso de respuesta crónica a un estímulo constante y la expresión del gen del TNF, principalmente se dá, entre muchos otros factores inmunológicos, para generar la respuesta inflamatoria aguda. Esto se comprueba con estudios in vivo e in vitro donde se demuestra que la expresión del gen tiene un proceso de atenuación cuando el antígeno está presente en forma constante.
Probablemente este mecanismo de regulación génica está operando en la lesión apical y sea la razón por la cual el TNF se encontró en menores cantidades con respecto al proceso inflamatorio agudo.
Todo esto significa que las células del sistema inmune en la pulpitis irreversible aguda desencadenarán un proceso inflamatorio que induce fenómenos como aumento de vascularización e ingreso de células que contribuyen a combatir la lesión iniciada. En pulpitis irreversible aguda, el TNF es un factor que contribuye, al igual que en otras regiones del organismo, al proceso inflamatorio agudo.
CONCLUSIONES
1. La expresión del gen TNF se dá solamente en procesos inflamatorios agudos.
2. La mayoría de las citoquinas estimulan y modulan la respuesta inmune.
3. El proceso inflamatorio agudo en el tejido pulpar conlleva a la necrosis; si se modula la acción de las citoquinas, se podría disminuir el proceso agudo en la pulpa y se podría prevenir en un alto porcentaje la necrosis.
RECOMENDACIONES
Se debe seguir explorando a nivel experimental el comportamiento del TNF y otras citoquinas en las diferentes patologías de cavidad oral, cuantificar la proteína en lesiones apicales agudas y analizar el proceso de reabsorción modulado pro las citoquinas.
APÉNDICE 1:
Equipos, materiales y reactivos empleados en la recolección y preparación de las muestras de tejido pulpar:
- Pieza de mano de alta velocidad.
- Fresa de Carburo No. 2.
- Mechero
- Sondas barbadas nuevas
- Pinzas algodoneras
- Viales estériles (cápsulas)
- Eppendorff Estériles
- Solución de RPMI
- Nevera
- Balanza de precisión (Chyo Jdpiter C-3-200 MDM).
- PBS (Solución salina buffer de fosfato)
- Azida de sodio (NaN3) al 0.02%, como preservativo
- Tritón x – 100 (T-octyl phenoxipoly-ethoxyethanol) SIGMA Ch. Co
- Homogenizador mecánico de pistilo. Thomas teflón pesthe tissue homogenizers
- Microcentrífuga. Fischer, Micro-centrifuge Model 235A
Equipos, materiales y reactivos utilizados para la Técnica de ELISA:
- Pozos para ELISA de fondo plano, en tiras x 8: EIA – RIA, COSTAR Co
- Marco portapozos de ELISA
- Micropipetas Pipetman de 0-20 ul y de 0.200 ul.
- Pipeta multicanal de 50-300 ul (Finnpippete Digital Multichanel. Lab-Systems)
- Puntas estériles amarillas para las micropipetas
- Cajas plásticas para lavados
- Frascos de vidrio estériles de 5 y 10 ml
- Propipeta
- Cuarto o cámara para incubación
- Lector de ELISA: Hypercon Micro-Reader III. R-300.
- Colagenasa a concentraciones de: 10.000, 1.000, 500, 250, 100 y 50 ngr (nanogramos).
- Proteína A con Fosfatasa Alcalina (ICN, Biochemicals). Sacar 5 ul del stock y adicionar 5 ml.
Soluciones y Buffers para el ELISA:
- PBS
- PBS – Twen. (Buffer de lavado): a 1 lt de PBS, se le agregan 0.5 ml de Twen-20.
- Substrato Buffer para revelar: para 1 lt a 800 ml de agua destilada agregar 97 ml de Diethanolamina. Austar el pH a 9.8 con HCL 1N, se pueden agregar 0.2 grs de azida de sodio (NaN3) y se completa hasta 1 lt con agua destilada.
- Solución Reveladora: A 10 ml del Buffer para revelado se agrega una pastilla de Paranitrofenil-fosfato PNP. (Phosphatase Substrate tablets SIGMA 104-105).
- Solución Frenadora: NaOH3 molar.
BIBLIOGRAFÍA
- 1.RAZ CAROLINE A: Viral inhibition of inflmation, Cell, Vol. 69, Mayo 1992.
- 2. ROJAS M. WILLIAM: Inmunología, 8a. Edición, Edit. C.I.B., 1990, Medellín; pags: 60,62,70,79.
- 3. MONSE DR., LASATER DR: Presence of inmunoglobulin-producing cells in periapical lesions. J Endondon. 1975, 1: 338-43.
- 4. PULVER, W.H., TAUBMAN. MA: Inmune components in human dental periapical lesions, Arch. Oral. Biol. 1978; 23: 435-43.
- 5. TORABINEJAD M. KETTERING J.D: Detection of imnmune complexes in human dental periapical lesion by anticomplement inmunoflorescense technique. Oral Surg. 1979; 48: 256-61.
- 6. TORABINEJAD M. KETTERING J.D: Identification and relative concentration of B and T.Lympocytes in human clinical periapical lesions. J Endodon. 1985, 11: 122-5.
- 7. ARTESE LUCIANO, PIATELLI ADRIANO: Inmuno reactivity for interleukin Beta and tumor necrosis factor Alpha and ultraestructural features of monocytes and macrophages in periapical granulomas. J: Endodon. 1991.
- 8. DINARELLOCA., Interleukin and its biological related cytokines. Adv. Inmunol 1989; 44: 153-205.
- 9. BERTOLINI D.R. NEDWIN G.E. Stimulation of bone resorption and inhibition of bone formation in vitro by human tumor necrosis factors. Nature, 319: 516, 1986.
- 10. GOWEN M: An interleukin and like factor stimulation bone resoption in vitro. Nature, 306: 378, 1983.
- 11. THOMSON B.M, MUNDY G.R: Tumor necrosis factor alpha and beta endu osteobalstic cells to stimulate ortodontic bone resoption. J Inmunol 138: 775, 1987.
- 12. SELTZER SAMUEL, BENDER J.B: Pulpa Dental. Edit. Manual Moderno. 3a. Edic. 1987.
- 13. NEWBROWND: Sugar and dental caries: a review of human studies. Science 217: 418, 1972.
- 16. BRANNSTROM M, LINO P.D: Pulpar response to early dental caries. J Dent. Res. 44: 1045, 1965.
- 17. BAUNE L.J: Dental pulp conditions in relation to caries leisons. Int. Dent. J. 20: 309, 1970.
Referencia
- 18. SELTZER S., RAINEY E: Correlation of scamming electron microscope fundings in inflamed and pathologically involved human pulps. Oral Surg. 43: 910, 1977.
- 19. TORNECK C.D: A report of studies into changes in the fine structure of the dental pulp in human caries pulpitis. J Endodont. 7:52, 1981.
- 20. ACKERMANS F., KLEIN J.P, FRANK R.M: Ultrastructural localization of inmunoglobulins in carious human dentine. Arch. Oral Biol. 26: 879, 1981.
- 21. DKAMURA T., KAHEKIA: Plasma components in deep carious lessions of human carious dentin. J Dent. R. 58: 2010, 1979.
- 22. HAHN CHIN-LO, FALKLER WILLIAM: Antibodies in normal and diseased pulps reactive with microorganisms isolated from deep caries. J Endodont. 18: 1, 1992.
- 23. SELTZER SAMUEL: Endodontology. Edit. LeaFebiger Philadelphia, 2a.Edic. 1988.
- 24. STEWART G.G: A study of bacteria found in root canals of anterior teeth and probable ingress. J Endodont. 2: 8, 1947.
- 25. HEDMAN W.J: An investigation into residual periapical infection alpha pulp canal therapy. Oral Surg. 4: 1173-9, 1951.
CLIC AQUÍ Y DÉJANOS TU COMENTARIO